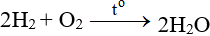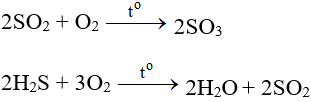H2S + O2 → SO2 + H2O | H2S ra SO2
H2S + O2 → SO2 + H2O là phản ứng oxi hóa khử. Bài viết này cung cấp đầy đủ thông tin về phương trình hóa học đã được cân bằng, điều kiện các chất tham gia phản ứng, hiện tượng (nếu có), ... Mời các bạn đón xem:
Phản ứng H2S + O2 → SO2 + H2O
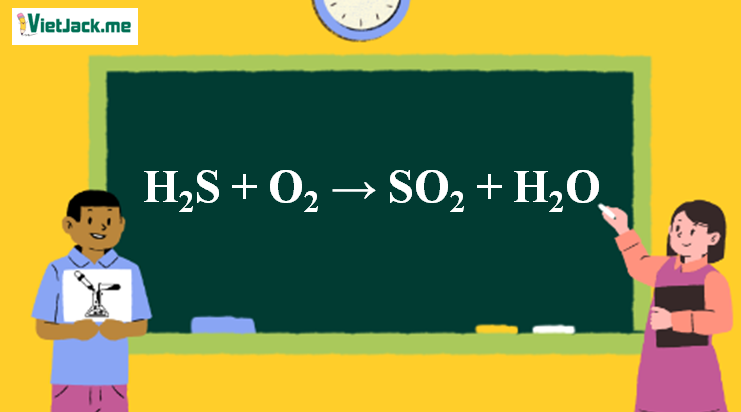
1. Phương trình phản ứng H2S ra SO2
2H2S + 3O2 → 2SO2 + 2H2O
2. Điều kiện phản ứng H2 tác dụng với O2 ra SO2
Điều kiện: Nhiệt độ cao, oxi dư.
Lưu ý: Nếu đốt cháy khí H2S ở nhiệt độ không cao hoặc thiếu oxi, khí H2S bị oxi hóa thành lưu tự do, màu vàng.
2H2S + O2 → 2S + 2H2O
3. Hiện tượng phản ứng xảy ra khi đốt cháy H2S trong không khí
Khi đốt H2S trong không khí, khí H2S cháy với ngọn lửa xanh nhạt; H2S bị oxi thành SO2.
4. Bản chất của các chất tham gia phản ứng
4.1. Bản chất của H2S (Hidro sunfua)
- Trong phản ứng trên H2S là chất khử.
- Ở nhiệt độ cao H2S sẽ bị cháy trong không khí.
4.2. Bản chất của O2 (Oxi)
Trong phản ứng trên O2 là chất oxi hoá.
5. Tính chất hóa học của H2S
5.1. Hidro sunfua tác dụng với kim loại mạnh
2Na + H2S → Na2S + H2
Hidro sunfua tác dụng với oxit kim loại (ít gặp).
5.2. Hidro sunfua tác dụng với dung dịch bazơ
(Có thể tạo thành 2 loại muối hiđrosunfua và sunfua)
H2S + NaOH → NaHS + H2O
H2S + 2NaOH → Na2S + 2H2O
5.3. Hidro sunfua tác dụng với dung dịch muối
Hidro sunfua tác dụng với dung dịch muối tạo muối không tan trong axit
H2S + CuSO4 → CuS + H2SO4
H2S có tính khử mạnh (vì S trong H2S có mức oxi hóa thấp nhất – 2).
5.4. Hidro sunfua tác dụng với oxi
2H2S + O2 → 2H2O + 2S (thiếu oxi, phản ứng xảy ra ở nhiệt độ thấp)
2H2S + 3O2 → 2H2O + 2SO2 (dư oxi, phản ứng xảy ra ở nhiệt độ cao)
5.5. Hidro sunfua tác dụng với các chất oxi hóa khác
H2S + 4Br2 + 4H2O → H2SO4 + 8HBr
H2S + 8HNO3 đặc → H2SO4 + 8NO2 + 4H2O
H2S + H2SO4 đặc → S + SO2+ 2H2O
6. Ứng dụng của H2S
- Hidro sunfua dùng để sản xuất lưu huỳnh và axit sunfuric dùng để sản xuất axit sunfuric, các chất trung gian sulfide vô cơ dùng làm nguyên liệu cho những bước tiếp theo của các quy trình sản xuất dược phẩm , thuốc nhuộm, thuốc trừ sâu…
- Sản xuất nước nặng trong một số nhà máy điện hạt nhân cũng là một vai trò của nó .
- Được con người dùng làm chất khử trùng trong nông nghiệp.
- Khí này còn được trong một số loại dầu cắt, chất làm mát và chất bôi trơn,…
7. Tính chất hóa học của O2
- Khi tham gia phản ứng, nguyên tử O dễ dàng nhận thêm 2e. Nguyên tử oxi có độ âm điện lớn (3,44), chỉ kém flo (3,98).
- Do vậy, oxi là nguyên tố phi kim hoạt động hoá học, có tính oxi hoá mạnh. Trong các hợp chất (trừ hợp chất với flo), nguyên tố oxi có số oxi hoá là -2.
- Oxi tác dụng với hầu hết các kim loại (trừ Au, Pt, ...) và các phi kim (trừ halogen). Oxi tác dụng với nhiều hợp chất vô cơ và hữu cơ.
7.1. Tác dụng với kim loại
Tác dụng với hầu hết kim loại (trừ Au và Pt), cần có to tạo oxit:
7.2. Tác dụng với phi kim
Tác dụng với hầu hết phi kim (trừ halogen), cần có to tạo oxit:
ĐB: Tác dụng với H2 nổ mạnh theo tỉ lệ 2:1 về số mol:
7.3. Tác dụng với hợp chất
- Tác dụng với các chất có tính khử:
- Tác dụng với các chất hữu cơ:
8. Bài tập vận dụng
Câu 1. Phương trình nào sau đây thể hiện tính khử của SO2?
A. SO2 + NaOH → NaHSO3
B. SO2 + Br2+ 2H2O → H2SO4
C. SO2 + CaO → CaCO3
D. SO2 + 2KOH → K2SO3 + H2O
Lời giải:
Đáp án: B
Câu 2. Sau khi làm thí nghiệm, có những khí thải độc hại: HCl, H2S, CO2, SO2. Dùng chất nào sau đây để loại bỏ chúng là tốt nhất?
A. Muối NaCl
B. Nước vôi trong
C. Dung dịch HCl
D. Dung dịch NaNO3
Lời giải:
Đáp án: B
Giải thích:
Dùng dung dịch nước vôi trong (Ca(OH)2) để loại bỏ các khí trên vì đều xảy ra phản ứng
Ca(OH)2 + 2HCl → CaCl2 + 2H2O
Ca(OH)2 + H2S → CaS + 2H2O
Ca(OH)2 + CO2 → CaCO3 + H2O
Ca(OH)2 + SO2 → CaSO3 + H2O
Câu 3. Cho dung dịch NaOH vào ống nghiệm đựng dung dịch FeCl3, hiện tượng quan sát được là:
A. Có kết tủa trắng xanh.
B. Có khí thoát ra.
C. Có kết tủa đỏ nâu.
D. Kết tủa màu trắng.
Lời giải:
Đáp án: C
Giải thích:
Cho dung dịch NaOH vào ống nghiệm đựng dung dịch FeCl3, xảy ra phản ứng:
3NaOH + FeCl3 → Fe(OH)3 ↓ + 3NaCl
Fe(OH)3kết tủa màu đỏ nâu
Câu 4. Dung dịch muối đồng (II) sunfat (CuSO4) có thể phản ứng với dãy chất:
A. CO2, NaOH, H2SO4, Fe
B. H2SO4, AgNO3, Ca(OH)2, Al
C. NaOH, BaCl2, Fe, H2SO4
D. NaOH, BaCl2, Fe, Al
Lời giải:
Đáp án: D
Giải thích:
Dung dịch CuSO4 phản ứng được với: NaOH, BaCl2, Fe, Al
CuSO4 + 2NaOH → Cu(OH)2↓ + Na2SO4
CuSO4 + BaCl2 → CuCl2 + BaSO4 ↓
CuSO4 + Fe → FeSO4 + Cu
3CuSO4 + 2Al → Al2(SO4)3 + 3Cu
Câu 5. Để nhận biết 3 lọ mất nhãn đựng 3 dung dịch CuCl2, FeCl3, MgCl2 ta dùng:
A. Quỳ tím
B. Dung dịch Ba(NO3)2
C. Dung dịch AgNO3
D. Dung dịch KOH
Lời giải:
Đáp án: D
Giải thích:
Để nhận biết 3 lọ mất nhãn đựng 3 dung dịch CuCl2, FeCl3, MgCl2 ta dùng dung dịch KOH vì tạo các kết tủa có màu khác nhau:
dung dịch CuCl2 tạo kết tủa xanh: CuCl2 + 2NaOH → Cu(OH)2 ↓xanh + 2NaCl
dung dịch FeCl3 tạo kết tủa đỏ nâu: FeCl3 + 3NaOH → Fe(OH)3 ↓đỏ nâu + 3NaCl
dung dịch MgCl2 tạo kết tủa trắng: MgCl2 + 2NaOH → Mg(OH)2 ↓trắng + 3NaCl
Câu 6. Cho từ từ đến hết 100 ml dung dịch FeCl2 0,5M vào 100 ml dung dịch AgNO3 1,2M. Sau phản ứng hoàn toàn được m gam kết tủa và dung dịch chứa các muối. Gía trị của m là?
A. 7,6 gam
B. 15,8 gam
C. 24,7 gam
D. 15,6 gam
Lời giải:
Đáp án: B
Giải thích:
FeCl2 + 3AgNO3 → 2AgCl↓ + Ag↓ + Fe(NO3)3
0,04 ←0,12 → 0,08 0,04 0,04
Vậy: m(kết tủa)= mAgCl+ mAg = 143,5 . 0,08 + 108 . 0,04 → m = 15,8(g)
Câu 7. Khí H2S là khí rất độc, để thu được khí H2S thoát ra khi làm thí nghiệm người ta đã dùng:
A. Dung dịch NaCl
B. Nước cất
C. Dung dịch axit HCl
D. Dung dịch NaOH
Lời giải:
Đáp án: D
Câu 8. Trường hợp nào sau đây không xảy ra phản ứng hóa học?
A. 3O2 + 2H2S → 2H2O + 2SO2
B. FeCl2 + H2S → FeS + 2HCl
C. SO2 + 2H2S → 3S + 2H2O
D. SO3 + 2NaOH → Na2SO4 + H2O
Lời giải:
Đáp án: B
Câu 9. Sục khí H2S vào dung dịch FeCl3, hiện tượng quan sát được:
A. Dung dịch trong suốt
B. Kết tủa trắng
C. Khí màu vàng thoát ra
D. có kết tủa vàng.
Lời giải:
Đáp án: D
Giải thích:
H2S + 2FeCl3 → S↓(vàng) + 2FeCl2 + 2HCl
Có kết tủa vàng
Câu 10. Khí N2 có lẫn tạp chất là H2S và SO2. Có thể dùng dung dịch nào sau đây để loại bỏ H2S và SO2 ra khỏi hỗn hợp?
A. NaCl
B. Pb(NO3)2
C. Ba(OH)2
D. H2SO4
Lời giải:
Đáp án: C
Giải thích:
Tinh chế là loại bỏ tạp chất bị lẫn trong chất cần tinh chế
Dẫn hỗn khí đi qua dung dịch Ba(OH)2chỉ có SO2 và H2S phản ứng
SO2 + Ca(OH)2 → CaCO3+ H2O
H2S + Ca(OH)2 → CaS + 2H2O
Câu 11. Thuốc thử nào sau đây dùng để phân biệt khí H2S với khí CO2?
A. dung dịch HCl
B. dung dịch Pb(NO3)2
C. dung dịch K2SO4
D. dung dịch NaCl
Lời giải:
Đáp án: B
Câu 12. Phương pháp nào sau đây dùng để điều chế kí sunfuro trong phòng thí nghiệm?
A. Đốt lưu huỳnh trong không khí
B. Cho dung dịch K2SO3 tác dụng với H2SO4đặc
C. Cho tinh thể K2SO3 tác dụng với H2SO4 đặc
D. Đốt cháy khí H2S trong không khí
Lời giải:
Đáp án: C
Giải thích:
A. Loại vì đây là phương pháp điều chế SO2trong công nghiệp.
B. Loại vì K2SO3 phải dùng dạng tinh thể chứ không phải dạng dd
C. Thỏa mãn:
Phương trình hóa học: Na2SO3 (rắn) + H2SO4 (dd) → Na2SO3 (dd) + H2O (l) + SO2 (k)
D. Loại
Câu 13. Cho khí H2S lội qua dung dịch CuSO4 thấy có kết tủa màu xám đen xuất hiện, chứng tỏ:
A. Có phản ứng oxi hóa- khử xảy ra
B. Có kết tủa CuS tạo thành, không tan trong axit mạnh
C. Axit sunfuric mạnh hơn axit sunfuahidric
D. Axit sunfuahidric mạnh hơn axit sunfuaric
Lời giải:
Đáp án: B
Giải thích:
H2S + CuSO4 → CuS↓ (kết tủa đen) + H2SO4
=> Có kết tủa CuS tạo thành, không tan trong axit mạnh.
Xem thêm các phương trình phản ứng hóa học khác:
Na2SO3 + HCl → NaCl + SO2 + H2O
Na2SO3 + H2SO4 → Na2SO4 + SO2 + H2O
Xem thêm các chương trình khác:
- Các dạng bài tập Tiếng Anh thông dụng nhất
- 3000 câu hỏi ôn tập môn Tiếng Anh có đáp án
- Toàn bộ kiến thức về cụm động từ | Định nghĩa và cách dùng
- 500 đoạn văn Tiếng Anh thông dụng nhất và cách làm
- 1000 câu hỏi ôn tập môn Công nghệ có đáp án
- 1000 câu hỏi ôn tập Giáo dục công dân
- 15000 câu hỏi ôn tập môn Toán có đáp án
- Wiki Toán | Khái niệm, định lí, tính chất, dạng bài, công thức
- Tuyển tập đề thi + chuyên đề ôn thi Toán Kangaroo các cấp độ (có đáp án 2025)
- 3000 câu hỏi ôn tập môn Vật lí có đáp án
- Tổng hợp Dạng bài - Công thức môn Vật lí
- 2000 câu hỏi ôn tập môn Tin học có đáp án
- 3000 câu hỏi ôn tập môn Lịch sử có đáp án
- 3000 câu hỏi ôn tập môn Địa lí có đáp án
- 2000 câu hỏi ôn tập môn Sinh học có đáp án
- Tổng hợp Dạng bài - Công thức môn Sinh học
- Tổng hợp về các tác giả văn học
- 3000 câu hỏi ôn tập môn Ngữ văn có đáp án
- Tổng hợp kiến thức Ngữ Văn
- Tuyển tập truyện dân gian, truyền thuyết, cổ tích,... Việt Nam
- Tổng hợp các đề đọc - hiểu có đáp án chi tiết
- Trò chơi Powerpoint | Game Powerpoint
- Tổng hợp bài thu hoạch BDTX Giáo viên mầm non (2025) theo Thông tư 12
- Tổng hợp bài thu hoạch BDTX Giáo viên tiểu học (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THCS (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THPT (2025)
- Tổng hợp thông tin, kiến thức chung
- Tiền tiểu học