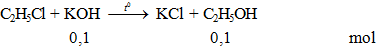C2H5Cl + KOH → KCl + C2H5OH l KOH ra KCl
C2H5Cl + KOH → KCl + C2H5OH là phản ứng thế nguyên tử halogen bằng nhóm OH. Bài viết này cung cấp đầy đủ thông tin về phương trình hóa học đã được cân bằng, điều kiện các chất tham gia phản ứng, hiện tượng (nếu có), ... Mời các bạn đón xem:
Phản ứng C2H5Cl + KOH to→ KCl + C2H5OH
1. Phản ứng hóa học
C2H5Cl + KOH to→ KCl + C2H5OH
2. Điều kiện phản ứng
Đun sôi nhẹ.
3. Cách thực hiện phản ứng
Đun nhẹ hỗn hợp gồm KOH và etyl clorua, đồng thời lắc đều.
4. Hiện tượng nhận biết phản ứng
Ban đầu chất lỏng trong ống nghiệm tách thành hai lớp. Sau phản ứng chất lỏng trong ống nghiệm trở thành đồng nhất.
5. Bản chất của các chất tham gia phản ứng
5.1. Bản chất của C2H5Cl (Etyl clorua)
C2H5Cl là dẫn xuất halogen của hidrocacbon nên tham gia được phản ứng thế nguyên tử halogen bằng nhóm -OH, đây là một trong những tính chất quan trọng của dẫn xuất halogen.
5.2. Bản chất của KOH (Kali hidroxit)
KOH là một bazo mạnh tác dụng được với C2H5Cl.
6. Tính chất hoá học của KOH
KOH là một bazo mạnh có khả năng làm thay đổi màu sắc các chất chỉ thị như khiến quỳ tím chuyển sang màu xanh, còn dung dịch phenolphtalein không màu thành màu hồng.
6.1. Tác dụng với oxit axit
Ở điều kiện nhiệt độ phòng, KOH tác dụng với SO2, CO2,...
KOH + SO2 → K2SO3 + H2O
KOH + SO2 → KHSO3
6.2. Tác dụng với axit
-
Tác dụng với axit tạo thành muối và nước
KOH(dd) + HCl(dd) → KCl(dd) + H2O
-
Tác dụng với các axit hữu cơ để tạo thành muối và thủy phân este, peptit
RCOOR1 + KOH → RCOOK + R1OH
6.3. Tác dụng với kim loại
KOH tác dụng với kim loại mạnh tạo thành bazo mới và kim loại mới.
KOH + Na → NaOH + K
6.4. Tác dụng với muối
KOH tác dụng với muối để tạo thành muối mới và axit mới
2KOH + CuCl2 → 2KCl + Cu(OH)2↓
6.5. KOH điện li mạnh
KOH là một bazo mạnh, trong nước phân ly hoàn toàn thành ion K+ và OH-
6.6. KOH phản ứng với một số oxit kim loại mà oxit, hidroxit của chúng lưỡng tính
KOH phản ứng được với một số oxit kim loại mà oxit, hidroxit của chúng lưỡng tính như nhôm, kẽm,…
2KOH + 2Al + 2H2O → 2KAlO2 + 3H2↑
2KOH + Zn → K2ZnO2 + H2↑
6.7. Phản ứng với một số hợp chất lưỡng tính
KOH + Al(OH)3 → KAlO2 + 2H2O
2KOH + Al2O3 → 2KAlO2 + H2O
7. Tính chất vật lý của KOH
- Khối lượng riêng: 2.044 g/cm3
- Độ pH: 13
- Nhiệt độ sôi: 1.327oC (1.6000 K; 2.421 oF)
- Nhiệt độ nóng chảy: 406 oC (679 K; 763 oF)
- Độ hòa tan trong nước:7 g/ml (0 oC); 121 g/ml (25 oC); 178 g/ml (100 oC)
- Khả năng hòa tan chất khác: có thể được hòa tan trong alcohol, glycerol và không tan được trong ether.
8. Câu hỏi vận dụng
Câu 1. KOH không phản ứng với chất nào sau đây?
A. CH3COOH. B. CH3Cl. C. HCOOC2H5. D. CH3OH.
Lời giải:
CH3OH không phản ứng với KOH.
Đáp án D.
Câu 2. Khi đun nóng etyl clorua trong KOH thu được
A. Etanol. B. etilen. C. axetilen. D. etan.
Lời giải:
C2H5Cl + KOH 
Đáp án A.
Câu 3. Đun nóng etyl clorua trong KOH thấy thu được 4,6 gam ancol. Số mol KOH đã dung để phản ứng là
A. 1. B. 0,1. C. 0,2. D. 0,5.
Lời giải:
Đáp án B.
Xem thêm các phương trình hóa học khác:
C2H5Br + KOH → KBr + C2H4 + H2O
Xem thêm các chương trình khác:
- Các dạng bài tập Tiếng Anh thông dụng nhất
- 3000 câu hỏi ôn tập môn Tiếng Anh có đáp án
- Toàn bộ kiến thức về cụm động từ | Định nghĩa và cách dùng
- 500 đoạn văn Tiếng Anh thông dụng nhất và cách làm
- 1000 câu hỏi ôn tập môn Công nghệ có đáp án
- 1000 câu hỏi ôn tập Giáo dục công dân
- 15000 câu hỏi ôn tập môn Toán có đáp án
- Wiki Toán | Khái niệm, định lí, tính chất, dạng bài, công thức
- Tuyển tập đề thi + chuyên đề ôn thi Toán Kangaroo các cấp độ (có đáp án 2024)
- 3000 câu hỏi ôn tập môn Vật lí có đáp án
- Tổng hợp Dạng bài - Công thức môn Vật lí
- 2000 câu hỏi ôn tập môn Tin học có đáp án
- 3000 câu hỏi ôn tập môn Lịch sử có đáp án
- 3000 câu hỏi ôn tập môn Địa lí có đáp án
- 2000 câu hỏi ôn tập môn Sinh học có đáp án
- Tổng hợp Dạng bài - Công thức môn Sinh học
- Tổng hợp về các tác giả văn học
- 3000 câu hỏi ôn tập môn Ngữ văn có đáp án
- Tổng hợp kiến thức Ngữ Văn
- Tuyển tập truyện dân gian, truyền thuyết, cổ tích,... Việt Nam
- Tổng hợp các đề đọc - hiểu có đáp án chi tiết
- Trò chơi Powerpoint | Game Powerpoint
- Tổng hợp bài thu hoạch BDTX Giáo viên mầm non (2025) theo Thông tư 12
- Tổng hợp bài thu hoạch BDTX Giáo viên tiểu học (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THCS (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THPT (2025)