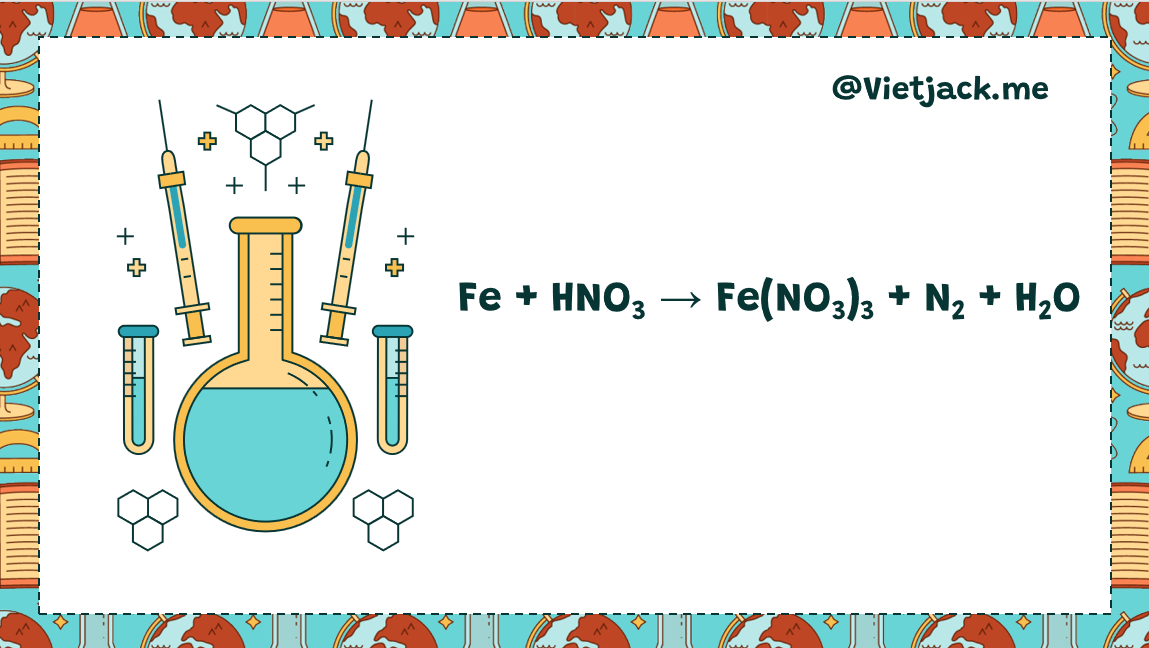
Fe + HNO3 → Fe(NO3)3 + N2 + H2O | Fe + HNO3 ra N2
Phản ứng Fe + HNO3 loãng ra N2 thuộc loại phản ứng oxi hóa khử đã được cân bằng chính xác và chi tiết nhất. Bên cạnh đó là một số bài tập có liên quan về Fe có lời giải, mời các bạn đón xem
Phản ứng Fe + HNO3 → Fe(NO3)3 + N2 + H2O
1. Phương trình phản ứng
10Fe + 36HNO3 loãng → 10Fe(NO3)3 + 3N2+ 18H2O
2. Điều kiện phản ứng
- Dung dịch HNO3 loãng dư.
3. Cách thực hiện phản ứng
Cho kim loại sắt tác dụng với dung dịch axit nitric loãng.
4. Hiện tượng nhận biết phản ứng
Kim loại tan dần tạo thành dung dịch màu vàng nâu và khí không màu thoát ra.
5. Bạn có biết
Fe thụ động với axit HNO3 đặc nguội, H2SO4 đặc nguội → có thể dùng thùng Fe chuyên chở axit HNO3 đặc nguội và H2SO4 đặc nguội.
6. Tính chất hóa học của sắt
Sắt là kim loại có tính khử trung bình. Khi tác dụng với chất oxi hóa yếu, sắt bị oxi hóa đến số oxi hóa +2.
Fe → +2Fe + 2e
Với chất oxi hóa mạnh, sắt bị oxi hóa đến số oxi hóa +3.
Fe → +3Fe + 3e
6.1. Tác dụng với phi kim
Ở nhiệt độ cao, sắt khử nguyên tử phi kim thành ion âm và bị oxi hóa đến số oxi hóa +2 hoặc +3.
+ Tác dụng với lưu huỳnh: 0Fe+0Sto→+2Fe−2S
+ Tác dụng với oxi: 3Fe+02O2to→Fe3−2O4
+ Tác dụng với clo: 02Fe+30Cl2to→2+3Fe−1Cl3
6.2. Tác dụng với axit
- Với dung dịch HCl, H2SO4 loãng, Fe bị oxi hóa đến số oxi hóa +2, giải phóng H2. Ví dụ:
Fe + H2SO4 → FeSO4 + H2
- Với dung dịch HNO3 và H2SO4 đặc nóng, Fe bị oxi hóa đến số oxi hóa +3, và không giải phóng H2. Ví dụ:
Fe + 4HNO3 loãng → Fe(NO3)3 + NO + 2H2O
Chú ý: Fe bị thụ động bởi các axit HNO3 đặc, nguội và H2SO4 đặc, nguội.
6.3. Tác dụng với dung dịch muối
Fe có thể khử được ion của các kim loại đứng sau nó trong trong dãy điện hóa của kim loại. Trong các phản ứng này, Fe thường bị oxi hóa đến số oxi hóa +2. Ví dụ:
Fe + CuSO4 → FeSO4 + Cu
Đặc biệt:
Fe + 2Ag+ → Fe2+ + 2Ag
Nếu Ag+ dư, tiếp tục có phản ứng:
Fe2+ + Ag+ → Fe3+ + Ag
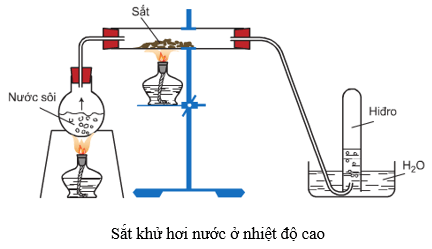
6.4. Tác dụng với nước
Ở nhiệt độ thường, sắt không khử được nước, nhưng ở nhiệt độ cao, sắt khử hơi nước tạo ra H2 và Fe3O4 hoặc FeO.
3Fe + 4H2O to<570oC→ Fe3O4 + 4H2
Fe + H2O to>570oC→FeO + H2
7. Tính chất vật lí của Sắt
- Màu xám hơi trắng, dễ ràn và dẻo cũng như có thể dát mỏng hay kéo sợi, khả năng dẫn điện và nhiệt không bằng nhôm hay đồng.
- Nhiễm từ ở nhiệt độ cao khoảng 800 độ C sẽ nhiễm từ và mất từ tính.
8. Bài tập vận dụng
Câu 1. Cho phản ứng sau: Fe + HNO3 → Fe(NO3)3 + N2 + H2O
Tổng hệ số tối giản trong phản ứng trên là:
A. 87 B. 64 D. 82 D. 108
Hướng dẫn giải
Đáp án A
10Fe + 36HNO3 → 10Fe(NO3)3 + 3N2 + 18H2O
Câu 2. Cho sắt tác dụng với dung dịch axit nitric loãng thu được chất khí không màu nhẹ hơn không khí. Phương trình hóa học xảy ra là:
A. 8Fe + 30HNO3 → 8Fe(NO3)3 + 3N2O + 15H2O
B. 10Fe + 36HNO3 → 10Fe(NO3)3 + 3N2+ 18H2O
C. Fe + 6HNO3 → Fe(NO3)3 + 3NO2 + 3H2O
D. Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O
Hướng dẫn giải
Đáp án: B
Khí không màu là sản phẩm khử của HNO3 có N2 và N2O. Trong đó, MN2 < Mkk
10Fe + 36HNO3 → 10Fe(NO3)3 + 3N2+ 18H2O
Câu 3: Cho phản ứng sau: Fe + HNO3 → Fe(NO3)3 + N2+ H2O
Hệ số tối giản của HNO3 trong phản ứng trên là:
A. 18 B. 30 C. 36 D. 32
Hướng dẫn giải
Đáp án C
10Fe + 36HNO3 → 10Fe(NO3)3 + 3N2 + 18H2O
Xem thêm các chương trình khác:
- Các dạng bài tập Tiếng Anh thông dụng nhất
- 3000 câu hỏi ôn tập môn Tiếng Anh có đáp án
- Toàn bộ kiến thức về cụm động từ | Định nghĩa và cách dùng
- 500 đoạn văn Tiếng Anh thông dụng nhất và cách làm
- 1000 câu hỏi ôn tập môn Công nghệ có đáp án
- 1000 câu hỏi ôn tập Giáo dục công dân
- 15000 câu hỏi ôn tập môn Toán có đáp án
- Wiki Toán | Khái niệm, định lí, tính chất, dạng bài, công thức
- Tuyển tập đề thi + chuyên đề ôn thi Toán Kangaroo các cấp độ (có đáp án 2024)
- 3000 câu hỏi ôn tập môn Vật lí có đáp án
- Tổng hợp Dạng bài - Công thức môn Vật lí
- 2000 câu hỏi ôn tập môn Tin học có đáp án
- 3000 câu hỏi ôn tập môn Lịch sử có đáp án
- 3000 câu hỏi ôn tập môn Địa lí có đáp án
- 2000 câu hỏi ôn tập môn Sinh học có đáp án
- Tổng hợp Dạng bài - Công thức môn Sinh học
- Tổng hợp về các tác giả văn học
- 3000 câu hỏi ôn tập môn Ngữ văn có đáp án
- Tổng hợp kiến thức Ngữ Văn
- Tuyển tập truyện dân gian, truyền thuyết, cổ tích,... Việt Nam
- Tổng hợp các đề đọc - hiểu có đáp án chi tiết
- Trò chơi Powerpoint | Game Powerpoint
- Tổng hợp bài thu hoạch BDTX Giáo viên mầm non (2025) theo Thông tư 12
- Tổng hợp bài thu hoạch BDTX Giáo viên tiểu học (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THCS (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THPT (2025)