SO2 + Na2O → Na2SO3 | SO2 ra Na2SO3
SO2 + Na2O → Na2SO3 là phản ứng hóa hợp. Bài viết này cung cấp đầy đủ thông tin về phương trình hóa học đã được cân bằng, điều kiện các chất tham gia phản ứng, hiện tượng (nếu có), ... Mời các bạn đón xem:
Phản ứng SO2 + Na2O → Na2SO3
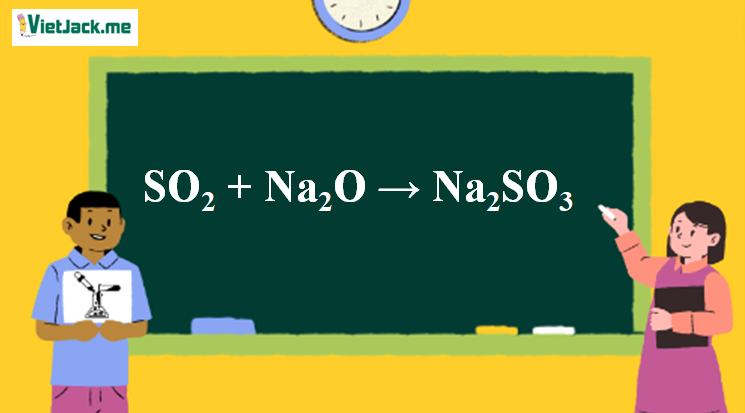
1. Phản trình phản ứng SO2 ra Na2SO3
SO2 + Na2O → Na2SO3
2. Điều kiện phản ứng SO2 ra Na2SO3
Nhiệt độ phòng.
3. Bản chất của các chất tham gia phản ứng
3.1. Bản chất của SO2 (Lưu huỳnh dioxit)
SO2 phản ứng được với oxi bazo tạo muối.
3.2. Bản chất của Na2O (Natri oxit)
Ở trong môi trường bình thường Na2O luôn sẵn sàng tác dụng với những oxit axit khác.
4. Tính chất hoá học của SO2
* Lưu huỳnh đioxit tác dụng với nước:
SO2 + H2O ⇋ H2SO3
* Lưu huỳnh đioxit tác dụng với dung dịch bazơ (có thể tạo thành 2 loại muối sunfit và hiđrosunfit)
SO2 + NaOH → NaHSO3
SO2 + 2NaOH → Na2SO3 + H2O
* Lưu huỳnh đioxit tác dụng với oxit bazơ → muối:
SO2 + CaO → CaSO3
SO2 vừa là chất khử, vừa là chất oxi hóa (do S trong SO2 có mức oxi hóa trung gian +4)
* Lưu huỳnh đioxit là chất oxi hóa:
SO2 + 2H2S → 3S + 2H2O
Lưu huỳnh đioxit là chất khử
5.Điều chế SO2
- Trong phòng thí nghiệm, SO2 được điều chế bằng cách cho muối sunfit tác dụng với axit mạnh như HCl, H2SO4.
Ví dụ: Na2SO3 + 2 HCl → 2 NaCl + H2O + SO2
- Ngoài ra, khí SO2 còn được điều chế bằng cách cho Cu tác dụng với H2SO4 đặc.
Cu + 2H2SO2 đặc → CuSO4 + SO2 + 2H2O
Khí SO2 được thu bằng phương pháp đẩy không khí.
6. Tính chất hóa học của Na2O
6.1. Natri oxit tác dụng với nước
Na2O tan trong nước để tạo thành dung dịch trong suốt, không màu, không mùi, không vị là bazo. Dung dịch này có tính ăn mòn như ăn mòn da, ăn mòn vải nên nó còn gọi khác là xút ăn da.
Na2O + H2O → NaOH
6.2. Natri oxit tác dụng với oxit axit
Ở trong môi trường bình thường sẵn sàng tác dụng với những oxit axit khác để tạo thành hỗn hợp mới là muối:
Na2O + CO2 → Na2CO3
6.3. Natri oxit tác dụng với dung dịch axit
Na2O + HCl→ NaCl + H2O
7. Bài tập vận dụng
Câu 1: Để nhận biết 3 khí không màu: SO2, O2, H2 đựng trong 3 lọ mất nhãn ta dùng
A. Giấy quỳ tím ẩm
B. Giấy quỳ tím ẩm và dùng que đóm cháy dở còn tàn đỏ
C. Than hồng trên que đóm
D. Dẫn các khí vào nước vôi trong
Lời giải:
Đáp án: B
Câu 2: CaO dùng làm chất khử chua đất trồng là ứng dụng tính chất hóa học gì của CaO?
A. Tác dụng với axit
B. Tác dụng với bazơ
C. Tác dụng với oxit axit
D. Tác dụng với muối
Lời giải:
Đáp án: A
Câu 3: Chất nào sau đây góp phần nhiều nhất vào sự hình thành mưa axit?
A. CO2
B. SO2
C. N2
D. O3
Lời giải:
Đáp án: B
Câu 4: Oxit được dùng làm chất hút ẩm (chất làm khô) trong phòng thí nghiệm là:
A. CuO
B. ZnO
C. PbO
D. CaO
Lời giải:
Đáp án: D
Câu 5: Dẫn hỗn hợp khí gồm CO2, CO, SO2 lội qua dung dịch nước vôi trong (dư), khí thoát ra là:
A. CO
B. CO2
C. SO2
D. CO2 và SO2
Lời giải:
Đáp án: A
Câu 6. Dãy oxit nào dưới đây tan trong nước cho dung dịch làm quỳ tím hóa xanh
A. CaO, SO2, CO2, N2O5
B. Na2O, CaO, BaO, K2O
C. BaO, FeO, CaO, N2O5
D. N2O5, K2O, CaO, SO3
Lời giải:
Đáp án: B
Câu 7. Dãy các oxit tác dụng được với dung dịch HCl:
A. CO2, CaO, CuO, FeO.
B. N2O, Na2O, ZnO, Fe2O3.
C. SO2, CaO, CuO, FeO.
D. CuO, BaO, Na2O, Fe2O3.
Lời giải:
Đáp án: D
Xem thêm các phương trình phản ứng hóa học khác:
Xem thêm các chương trình khác:
- Các dạng bài tập Tiếng Anh thông dụng nhất
- 3000 câu hỏi ôn tập môn Tiếng Anh có đáp án
- Toàn bộ kiến thức về cụm động từ | Định nghĩa và cách dùng
- 500 đoạn văn Tiếng Anh thông dụng nhất và cách làm
- 1000 câu hỏi ôn tập môn Công nghệ có đáp án
- 1000 câu hỏi ôn tập Giáo dục công dân
- 15000 câu hỏi ôn tập môn Toán có đáp án
- Wiki Toán | Khái niệm, định lí, tính chất, dạng bài, công thức
- Tuyển tập đề thi + chuyên đề ôn thi Toán Kangaroo các cấp độ (có đáp án 2024)
- 3000 câu hỏi ôn tập môn Vật lí có đáp án
- Tổng hợp Dạng bài - Công thức môn Vật lí
- 2000 câu hỏi ôn tập môn Tin học có đáp án
- 3000 câu hỏi ôn tập môn Lịch sử có đáp án
- 3000 câu hỏi ôn tập môn Địa lí có đáp án
- 2000 câu hỏi ôn tập môn Sinh học có đáp án
- Tổng hợp Dạng bài - Công thức môn Sinh học
- Tổng hợp về các tác giả văn học
- 3000 câu hỏi ôn tập môn Ngữ văn có đáp án
- Tổng hợp kiến thức Ngữ Văn
- Tuyển tập truyện dân gian, truyền thuyết, cổ tích,... Việt Nam
- Tổng hợp các đề đọc - hiểu có đáp án chi tiết
- Trò chơi Powerpoint | Game Powerpoint
- Tổng hợp bài thu hoạch BDTX Giáo viên mầm non (2025) theo Thông tư 12
- Tổng hợp bài thu hoạch BDTX Giáo viên tiểu học (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THCS (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THPT (2025)
