K2Cr2O7 + HCl → CrCl3 + KCl + Cl2 + H2O | K2Cr2O7 ra CrCl3
K2Cr2O7 + HCl → CrCl3 + KCl + Cl2 + H2O là phản ứng oxi hóa khử. Bài viết này cung cấp đầy đủ thông tin về phương trình hóa học đã được cân bằng, điều kiện các chất tham gia phản ứng, hiện tượng (nếu có), ... Mời các bạn đón xem:
Phản ứng K2Cr2O7 + HCl → CrCl3 + KCl + Cl2 + H2O
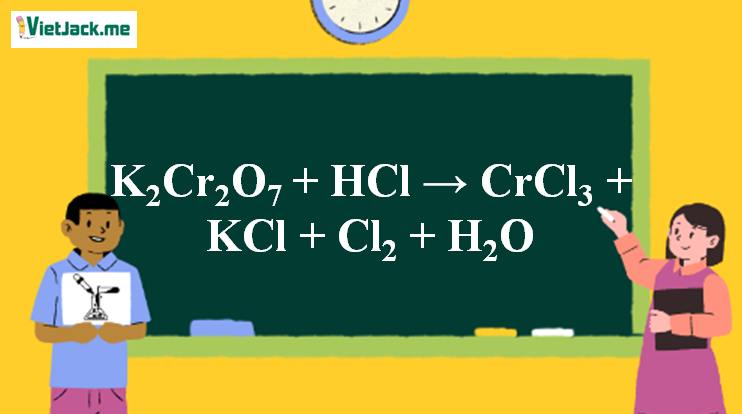
1. Phương trình phản ứng K2Cr2O7 tác dụng HCl
K2Cr2O7(da cam) + 14HCl → 2CrCl3(vàng) + 2KCl + 3Cl2(vàng lục) + 7H2O
2. Cân bằng phản ứng K2Cr2O7 + HCl → CrCl3 + KCl + Cl2 + H2O
Phương trình phản ứng: K2Cr2O7 + 14HCl → 2CrCl3 + 2KCl + 3Cl2 + 7H2O
3. Điều kiện phản ứng xảy ra K2Cr2O7 ra Cl2
Nhiệt độ thường
4. Bản chất của các chất tham gia phản ứng
4.1. Bản chất của K2Cr2O7 (Kali dicromat)
- Trong phản ứng trên K2Cr2O7 là chất oxi hoá.
- K2Cr2O7 là một chất oxi hoá mạnh tác dụng được với các axit.
4.2. Bản chất của HCl (Axit clohidric)
Trong phản ứng trên HCl là chất khử.
5. Tính chất của kaliđicromat
5.1. Tính chất vật lí
Là tinh thể tam tà màu đỏ - da cam.
Nhiệt độ nóng chảy: 398oC; phân hủy ở 500oC.
Trong không khí K2Cr2O7 không chảy rữa.
Tan nhiều trong nước cho dung dịch màu da cam – màu đặc trưng của ion Cr2O72-.
Tan trong SO2 lỏng; không tan trong rượu và ete. Muối này có độ tan thay đổi theo nhiệt độ, K2Cr2O7 có vị đắng.
5.2. Tính chất hóa học
- Phân hủy ở 500oC
4K2Cr2O7 4K2CrO4 + 2Cr2O3 + 3O2
- Tác dụng với dung dịch kiềm
K2Cr2O7(da cam) + 2KOH(vàng) → 2K2CrO4 + H2O
- K2Cr2O7 có tính oxi hóa mạnh (nhất là trong môi trường axit – tính oxi hóa như axit cromic).
K2Cr2O7 + 14HCl → 2CrCl3 + 2KCl + 3Cl2 + 7H2O
K2Cr2O7 + 3SO2 + H2SO4 → Cr2(SO4)3 + K2SO4 + H2O
K2Cr2O7 + 6FeSO4 + 7H2SO4 → Cr2(SO4)3 + 3Fe2(SO4)3 + K2SO4 + 7H2O
Ở trạng thái rắn, K2Cr2O7 có thể oxi hóa được S, P, C khi đun nóng:
K2Cr2O7 + 2C → K2CO3 + Cr2O3 + CO
5.3. Ứng dụng
Kali dicromat thường được sử dụng trong sản xuất phèn kali crom và cũng được sử dụng trong ngành thuộc da. K2CR2O7 được sử dụng làm nguyên liệu sản xuất axit cromic, được sử dụng để làm sạch dụng cụ thủy tinh (như các hợp chất crom (VI) khác, natri dicromat, crom trioxide).
6. Tính chất hóa học của HCl
Dung dịch axit HCl có đầy đủ tính chất hoá học của một axit mạnh.
6.1. Tác dụng chất chỉ thị
Dung dịch HCl làm quì tím hoá đỏ (nhận biết axit)
HCl → H+ + Cl-
6.2. Tác dụng với kim loại
Tác dụng với KL (đứng trước H trong dãy Bêkêtôp) tạo muối (với hóa trị thấp của kim loại) và giải phóng khí hidrô (thể hiện tính oxi hóa)
Fe + 2HCl 
2Al + 6HCl 
Cu + HCl → không có phản ứng
6.3. Tác dụng với oxit bazo và bazo
Sản phẩm tạo muối và nước
NaOH + HCl → NaCl + H2 O
CuO + 2HCl 
Fe2 O3 + 6HCl
6.4. Tác dụng với muối (theo điều kiện phản ứng trao đổi)
CaCO3 + 2HCl → CaCl2 + H2O + CO2↑
AgNO3 + HCl → AgCl↓ + HNO3
(dùng để nhận biết gốc clorua )
Ngoài tính chất đặc trưng là axit , dung dịch axit HCl đặc còn thể hiện vai trò chất khử khi tác dụng chất oxi hoá mạnh như KMnO4, MnO2, K2 Cr2O7, MnO2, KClO3 ……
4HCl + MnO2 
K2 Cr2 O7 + 14HCl → 3Cl2 + 2KCl + 2CrCl3 + 7H2 O
Hỗn hợp 3 thể tích HCl và 1 thể tích HNO3 đặc được gọi là hỗn hợp nước cường toan ( cường thuỷ) có khả năng hoà tan được Au ( vàng)
3HCl + HNO3 → 2Cl + NOCl + 2H2O
NOCl → NO + Cl
Au + 3Cl → AuCl3
7. Bài tập vận dụng liên quan
Câu 1. Cho phản ứng K2Cr2O7 + HCl → KCl + CrCl3 + Cl2 + H2O. Số phân tử HCl đóng vai trò môi trường là
A. 3
B. 6
C. 8
D.14
Lời giải:
Câu 2. Trong phản ứng
K2Cr2O7 + HCl → CrCl3 + KCl + Cl2 + H2O
Tổng hệ số cân bằng tối giản của phản ứng là
A. 28
B. 29
C. 30
D. 31
Lời giải:
Phương trình hóa học
K2Cr2O7 + 14HCl → 2CrCl3 + 2KCl + 3Cl2 + 7H2O
Tổng hệ số cân bằng trong phương trình là: 1 + 14 + 2 + 2 + 3 + 7 = 29
Câu 3. Khi cho dung dịch kiềm vào dung dịch K2Cr2O7 thì có hiện tượng
A. Màu da cam của dung dịch chuyển thành không màu
B. Dung dịch không màu chuyển thành màu vàng
C. Màu vàng của dung dịch chuyển thành màu da cam
D. Màu da cam của dung dịch chuyển thành màu vàng
Lời giải:
Khi cho dung dịch kiềm vào dung dịch K2Cr2O7 thì có hiện tượng màu da cam của dung dịch chuyển thành màu vàng
Cr2O72- (màu da cam ) + 2OH- → 2CrO42- (màu vàng)+ H2O
Câu 4. Cho các phát biểu sau:
(1). K2Cr2O7 có màu da cam, là chất oxi hóa mạnh.
(2). Kim loại Al và Cr đều phản ứng với dung dịch HCl theo cùng tỷ lệ.
(3). CrO3 là một oxit axit, là chất oxi mạnh, bốc cháy khi tiếp xúc với lưu huỳnh, photpho,...
(4). Cr2O3 được dùng để tạo màu lục cho đồ sứ, đồ thủy tinh.
(5). Hợp chất crom (VI) vừa có tính oxi hóa, vừa có tính khử.
(6). Crom (III) oxit và crom (III) hiđroxit đều là chất có tính lưỡng tính.
Tổng số phát biểu đúng là
A. 2
B. 3
C. 4.
D. 5
Lời giải:
(1) đúng
(2) Sai , Cr tác dụng HCl tỉ lệ 1 :2
(3) Đúng
(4) Đúng
(5) Sai, Crom (VI) chỉ có tính oxh
(6) Đúng
Câu 5. Khi cho Kalidicromat vào dung dịch HCl dư đun nóng xảy ra phản ứng:
K2Cr2O7 + HCl → KCl + CrCl3 + Cl2 + H2O
Nếu dùng 5,88 gam K2Cr2O7 thì số mol HCl bị Oxi hóa là:
A. 0,14 mol.
B. 0,28 mol.
C. 0,12 mol.
D. 0,06 mol.
Lời giải:
Số mol HCl bị oxi hóa chính là số mol HCl chuyển thành Cl2
Phương trình phản ứng hóa học
K2Cr2O7 + 14HCl → 2KCl + 2CrCl3 + 3Cl2 + 7H2O
⇒ nHCl bị OXH = 2nCl2 = 6nK2Cr2O7 = 6 × 0,02 = 0,12 mol
Câu 6. Nung hỗn hợp bột gồm 15,2 gam Cr2O3 và m gam Al ở nhiệt độ cao. Sau khi phản ứng hoàn toàn thu được 23,3 gam hỗn hợp rắn X. Cho toàn bộ hỗn hợp X phản ứng với axit HCl dư thấy thoát ra V lit khí H2 (dktc). Giá trị của V là :
A. 10,08 lit
B. 4,48 lit
C. 7,84 lit
D. 3,36 lit
Lời giải:
Áp dụng Bảo toàn khối lượng:
mAl + mCr2O3 = mX
=> nAl = 0,3 mol; nCr2O3 = 0,1 mol
Phương trình phản ứng hóa học
2Al + Cr2O3 → Al2O3 + 2Cr
Sau phản ứng có: nCr= 0,2 mol ;
nAl= 0,1 mol là phản ứng với axit tạo H2
Phương trình phản ứng hóa học
Cr + 2HCl → CrCl2 + H2
Al + 3HCl → AlCl3 + 1,5H2
=> nH2 = nCr+ nAl.1,5 = 0,35 mol
=> VH2 = n.22,4 = 0,35.22,4 = 7,84 lit
Câu 7. Crom không phản ứng với chất nào sau đây ?
A. dung dịch H2SO4 loãng, đun nóng
B. dung dịch HNO3 đặc nguội
C. dung dịch HNO3 đặc, đun nóng
D. dung dịch H2SO4 đặc, đun nóng
Lời giải:
Câu 8. Khối lượng K2Cr2O7 cần dùng để oxi hoá hết 0,3 moi FeSO4 trong môi trường dung dịch H2SO4 loãng là:
A. 29,4 gam
B. 59,2 gam.
C. 24,9 gam.
D. 14,7 gam
Lời giải:
K2Cr2O7 + 6FeSO4 + 7H2SO4 → 3Fe2(SO4)3 + Cr2(SO4)3 + K2SO4+ 7H2O
0,05 ← 0,3 (mol)
mK2Cr2O7 = 0,05.294 = 14,7 gam
Câu 9. Muốn điều chế 6,72 lít khí Clo (đktc) thì khối lượng K2Cr2O7 tối thiều cần dùng đế tác dụng với dung dịch HCl đặc, dư là
A. 29,4 gam.
B. 27,4 gam.
C. 24,9 gam.
D. 26,4 gam
Lời giải:
Ta có: nCl2= = 0,3 (mol)
Phương trình hóa học
K2Cr2O7 + 14HCl → 2CrCl3 + 2KCl + 3Cl2 + 7H2O
Theo phương trình hóa học: nK2Cr2O7= nCl2= .0,3 = 0,1 (mol)
Khối lượng K2Cr2O7 tối thiểu cần lấy là: nK2Cr2O7= 0,1.294 = 29,4(g)
Câu 10. Dung dịch FeSO4 không làm mất màu dung dịch nào sau đây?
A. Dung dịch K2Cr2O7 trong môi trường H2SO4
B. Dung dịch KMnO4 trong môi trường H2SO4
C. Dung dịch Br2 trong môi trường H2SO4
D. Dung dịch NaOH
Lời giải:
Các dung dịch KMnO4/ H2SO4; K2Cr2O7/ H2SO4;
Br2 đều là các chất oxi hóa → Fe2+ sẽ có phản ứng oxi hóa khử làm mất màu các dung dịch trên
6FeSO4 + K2Cr2O7 + 7H2SO4→ 3Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + 7H2O
10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
2FeSO4+ Br2 + H2SO4→ Fe2(SO4)3+ 2HBr
Câu 11. Dãy các chất chỉ thể hiện tính oxi hóa là:
A. HNO3; KMnO4; Fe(NO3)3
B. O2; H2SO4 đặc
C. HNO3; KMnO4; Fe(NO3)2
D. KMnO4, Zn, HCl
Lời giải:
Chất chỉ thể hiện mình tính oxh tức là số oxh cao nhất O2; H2SO4 đặc
A sai vì Fe(NO3)3 thể hiện cả tính khử và tính oxi hóa
B đúng
C sai do Fe(NO3)2 thể hiện cả tính khử và tính oxi hóa
D sai do HCl thể hiện cả 2 tính còn Zn là chất khử
Câu 12. Khi cho dung dịch kiềm vào dung dịch K2Cr2O7 thì có hiện tượng
A. Màu da cam của dung dịch chuyển thành không màu
B. Dung dịch không màu chuyển thành màu vàng
C. Màu vàng của dung dịch chuyển thành màu da cam
D. Màu da cam của dung dịch chuyển thành màu vàng
Lời giải:
Khi cho dung dịch kiềm vào dung dịch K2Cr2O7 thì có hiện tượng màu da cam của dung dịch chuyển thành màu vàng
Cr2O72- (màu da cam ) + 2OH- → 2CrO42- (màu vàng)+ H2O
Câu 13. Chọn phát biểu đúng về phản ứng của crom với phi kim:
A. Ở nhiệt độ thường crom chỉ phản ứng với flo.
B. Ở nhiệt độ cao, oxi sẽ oxi hóa crom thành Cr(VI).
C. Lưu huỳnh không phản ứng được với crom.
D. Ở nhiệt độ cao, clo sẽ oxi hóa crom thành Cr(II).
Lời giải:
B sai vì oxi phản ứng với crom tạo Cr2O3
C sai vì lưu huỳnh có phản ứng với crom ở nhiệt độ cao
D sai vì clo sẽ oxi hóa crom thành CrCl3
Câu 14. Các kim loại nào sau đây luôn được bảo vệ trong môi trường không khí, nước nhờ lớp màng oxit?
A. Al và Ca.
B. Fe và Cr.
C. Cr và Al
D. Fe và Mg.
Lời giải:
Các kim loại luôn được bảo vệ trong môi trường không khí, nước nhờ lớp màng oxit là Al và Cr
Xem thêm các phương trình hóa học khác:
Xem thêm các chương trình khác:
- Các dạng bài tập Tiếng Anh thông dụng nhất
- 3000 câu hỏi ôn tập môn Tiếng Anh có đáp án
- Toàn bộ kiến thức về cụm động từ | Định nghĩa và cách dùng
- 500 đoạn văn Tiếng Anh thông dụng nhất và cách làm
- 1000 câu hỏi ôn tập môn Công nghệ có đáp án
- 1000 câu hỏi ôn tập Giáo dục công dân
- 15000 câu hỏi ôn tập môn Toán có đáp án
- Wiki Toán | Khái niệm, định lí, tính chất, dạng bài, công thức
- Tuyển tập đề thi + chuyên đề ôn thi Toán Kangaroo các cấp độ (có đáp án 2024)
- 3000 câu hỏi ôn tập môn Vật lí có đáp án
- Tổng hợp Dạng bài - Công thức môn Vật lí
- 2000 câu hỏi ôn tập môn Tin học có đáp án
- 3000 câu hỏi ôn tập môn Lịch sử có đáp án
- 3000 câu hỏi ôn tập môn Địa lí có đáp án
- 2000 câu hỏi ôn tập môn Sinh học có đáp án
- Tổng hợp Dạng bài - Công thức môn Sinh học
- Tổng hợp về các tác giả văn học
- 3000 câu hỏi ôn tập môn Ngữ văn có đáp án
- Tổng hợp kiến thức Ngữ Văn
- Tuyển tập truyện dân gian, truyền thuyết, cổ tích,... Việt Nam
- Tổng hợp các đề đọc - hiểu có đáp án chi tiết
- Trò chơi Powerpoint | Game Powerpoint
- Tổng hợp bài thu hoạch BDTX Giáo viên mầm non (2025) theo Thông tư 12
- Tổng hợp bài thu hoạch BDTX Giáo viên tiểu học (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THCS (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THPT (2025)
