Cu + HNO3 (đặc, nóng) → Cu(NO3)2 + NO2 + H2O | Cu ra Cu(NO3)2 | Cu + HNO3 ra NO2|
Cu + HNO3 (đặc, nóng) → Cu(NO3)2 + NO2 + H2O là phản ứng oxi hóa - khử. Bài viết này cung cấp đầy đủ thông tin về phương trình hóa học đã được cân bằng, điều kiện các chất tham gia phản ứng, hiện tượng (nếu có), ... Mời các bạn đón xem:
Phản ứng: Cu + HNO3 (đặc, nóng) → Cu(NO3)2 + NO2 + H2O
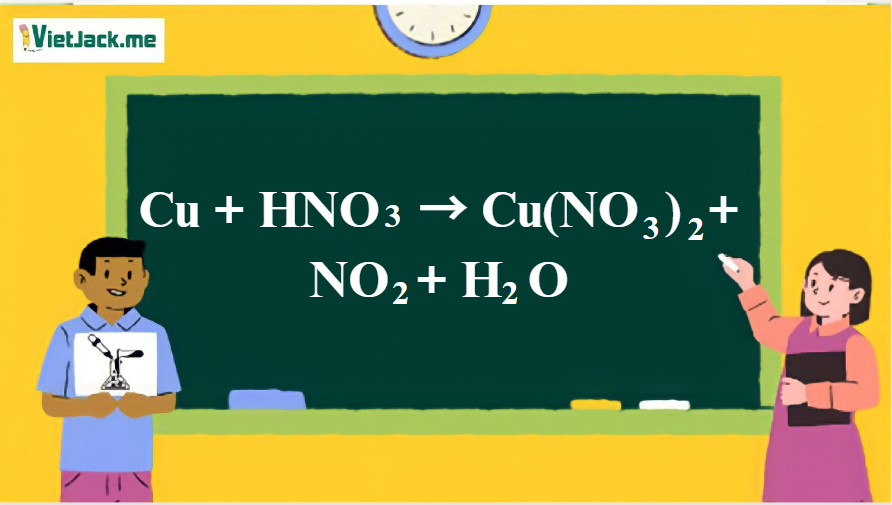
1. Phương trình hóa học phản ứng giữa Cu và HNO3( đặc, nóng)
Cu + 4HNO3 → Cu(NO3)2 + NO2 + 2H2O
2. Điều kiện để Cu tác dụng với HNO3 đặc
Phản ứng giữa đồng và HNO3 đặc diễn ra ở nhiệt độ thường.
3. Cách tiến hành thí nghiệm
Lấy vào ống nghiệm 1 – 2ml dung dich HNO3 đặc, rồi cho một mảnh nhỏ đồng kim loại vào ống nghiệm đó.
4. Hiện tượng phản ứng
Chất rắn màu đỏ của đồng (Cu) tan dần trong dung dịch, dung dịch có màu xanh của Cu(NO3)2 và sinh ra khí màu nâu đỏ nitơ đioxit (NO2).
5. Bản chất của các chất tham gia phản ứng
5.1 Bản chất của Cu
- Trong phản ứng trên Cu là chất khử.
- Cu là kim loại phản ứng được với các axit oxi hoá mạnh như axit HNO3 và H2SO4 đặc, nóng.
5.2 Bản chất của HNO3
- Trong phản ứng trên HNO3 là chất oxi hoá.
- Đây là một monoaxit mạnh, có tính oxi hóa mạnh có thể nitrat hóa nhiều hợp chất vô cơ.
6. Mở rộng kiến thức về đồng (Cu)
6.1. Vị trí trong bảng tuần hoàn và cấu hình electron nguyên tử
- Đồng (Cu) ở ô số 29, thuộc nhóm IB, chu kì 4 của bảng tuần hoàn.
- Nguyên tử Cu có cấu hình electron bất thường: 1s22s22p63s23p63d104s1. Viết gọn là [Ar]3d104s1.
- Trong các hợp chất Cu có số oxi hóa +1 hoặc +2.
6.2. Tính chất vật lí
- Đồng là kim loại màu đỏ, có khối lượng riêng lớn (D = 8,98 g/cm3), nóng chảy ở 1083oC.
- Đồng tinh khiết tương đối mềm, dễ kéo dài và dát mỏng.
- Đồng dẫn điện và dẫn nhiệt tốt, chỉ kém bạc và hơn hẳn các kim loại khác.
6.3. Tính chất hóa học
Đồng là kim loại kém hoạt động, có tính khử yếu.
a. Tác dụng với phi kim
- Ở nhiệt độ thường, đồng có thể tác dụng với clo, brom nhưng tác dụng rất yếu với oxi. Ví dụ:
Cu + Cl2 → CuCl2
- Khi đun nóng, đồng tác dụng được với một số phi kim như oxi, lưu huỳnh. Ví dụ:
2Cu + O2 2CuO
- Chú ý: đồng không tác dụng được với hidro, nitơ, cacbon.
b. Tác dụng với axit
- Đồng không khử được nước và ion H+ trong các dung dịch HCl và H2SO4 loãng.
- Với các dung dịch H2SO4 đặc, nóng và HNO3, đồng khử xuống và xuống hoặc :
Cu + 2H2SO4đặc CuSO4 + SO2 + 2H2O
Cu + 4HNO3 đặc → Cu(NO3)2 + 2NO2 + 2H2O
3Cu + 8HNO3 loãng → 3Cu(NO3)2 + 2NO + 4H2O
6.4. Ứng dụng của Cu
Đồng là vật liệu dễ dát mỏng, dễ uốn, có khả năng dẫn điện và dẫn nhiệt tốt, vì vậy nó được sử dụng một cách rộng rãi trong sản xuất các sản phẩm:
- Dây điện.
- Que hàn đồng.
- Tay nắm và các đồ vật khác trong xây dựng nhà cửa.
- Đúc tượng: Ví dụ tượng Nữ thần Tự Do chứa 81,3 tấn (179.200 pao) đồng hợp kim
- Cuộn từ của nam châm điện.
- Động cơ, đặc biệt là các động cơ điện.
- Động cơ hơi nước của Watt.
- Rơ le điện, dây dẫn điện giữa các bảng mạch và các chuyển mạch điện.
- Ống chân không, ống tia âm cực và magnetron trong các lò vi ba.
- Bộ dẫn sóng cho các bức xạ vi ba.
- Việc sử dụng đồng trong các mạch IC đã trở nên phổ biến hơn để thay thế cho nhôm vì độ dẫn điện cao của nó.
- Là một thành phần trong tiền kim loại.
- Trong đồ nhà bếp, chẳng hạn như chảo rán.
- Phần lớn các đồ dùng bằng niken trắng dùng ở bàn ăn (dao, nĩa, thìa) có chứa một lượng đồng nhất định.
- Trong chế tạo đồ đựng thức ăn bằng bạc (hàm lượng bạc từ 92,5% trở lên), có chứa một số phần trăm đồng.
- Là thành phần của gốm kim loại và thủy tinh màu.
- Các loại nhạc khí, đặc biệt là các loại nhạc khí từ đồng thau.
- Làm bề mặt tĩnh sinh học trong các bệnh viện hay các bộ phận của tàu thủy để chống hà.
7. Tính chất hóa học của HNO3
Kim loại hay phi kim khi gặp axit HNO3 đều bị oxi hóa về trạng thái oxi hóa cao nhất.
7.1 Với kim loại: HNO3 oxi hóa hầu hết các kim loại (trừ vàng (Au) và platin(Pt))
* Với những kim loại có tính khử yếu: Cu, Ag, ...
Ví dụ:
Cu + 4HNO3(đ) → Cu(NO3)2 + 2NO2 + 2H2O
3Cu + 8HNO3(l) → 3Cu(NO3)2 + 2NO + 4H2O
* Khi tác dụng với những kim loại có tính khử mạnh hơn: Mg, Zn, Al, ...
- HNO3 đặc bị khử đến NO2.
Ví dụ:
Mg + 4HNO3(đ) → Mg(NO3)2 + 2NO2 + 2H2O.
- HNO3 loãng bị khử đến N2O hoặc N2.
8Al + 30HNO3(l) → 8Al(NO3)3 + 3N2O + 15H2O
- HNO3 rất loãng bị khử đến NH3(NH4NO3).
4Zn + 10HNO3 (rất loãng) → 4Zn(NO3)2 + NH4NO3 + 3H2O
* Lưu ý: Fe, Al, Cr bị thụ động hóa trong dung dịch HNO3 đặc nguội.
7.2 Với phi kim:
Khi đun nóng HNO3 đặc có thể tác dụng với phi: C, P, S, …(trừ N2 và halogen).
S + 6HNO3(đ) → H2SO4 + 6NO2 + 2H2O
7.3 Với hợp chất:
- H2S, HI, SO2, FeO, muối sắt (II), … có thể tác dụng với HNO3 nguyên tố bị oxi hoá trong hợp chất chuyển lên mức oxi hoá cao hơn.
Ví dụ:
3FeO + 10HNO3(đ) → 3Fe(NO3)3 + NO + 5H2O
3H2S + 2HNO3(đ) → 3S + 2NO + 4H2O
- Nhiều hợp chất hữu cơ như giấy, vải, dầu thông, … bốc cháy khi tiếp xúc với HNO3 đặc.
8. Bài tập vận dụng liên quan
Câu 1: Cho các tính chất sau:
(a) kim loại có màu đỏ.
(b) kim loại nhẹ.
(c) nóng chảy ở nhiệt độ cao.
(d) tương đối cứng.
(e) dễ kéo dài và dát mỏng.
(g) dẫn điện tốt.
(h) dẫn nhiệt kém.
Có bao nhiêu tính chất vật lí là tính chất vật lí của kim loại đồng?
A. 3. B. 4. C. 5. D. 6.
Hướng dẫn giải
Đáp án B
Tính chất vật lí của kim loại đồng:
- Là kim loại màu đỏ, dẻo, dễ kéo sợi và dát mỏng (có thể dát mỏng đến 0,0025 mm, mỏng hơn giấy viết 5 - 6 lần).
- Có độ dẫn điện và dẫn nhiệt rất cao (chỉ kém bạc).
- Khối lượng riêng lớn 8,98 g/cm3.
- Nhiệt độ nóng chảy cao 1083oC.
→ Có 4 tính chất vật lí là tính chất vật lí của đồng: (a), (c), (e), (g)
Câu 2: Để nhận biết ion nitrat, thường dùng Cu và dung dịch axit sufuric loãng đun nóng là vì
A.phản ứng tạo ra kết tủa màu vàng và dung dịch có màu xanh.
B. phản ứng tạo ra dung dịch có màu xanh và khí không mùi làm xanh giấy quỳ ẩm.
C. phản ứng tạo ra kết tủa màu xanh.
D. phản ứng tạo dung dịch có màu xanh và khí không màu hóa nâu trong không khí.
Hướng dẫn giải
Đáp án D
Xảy ra phản ứng:
3Cu + 8H+ + 2NO3- → 3Cu2+ + 2NO + 4H2O
Dung dịch Cu2+ có màu xanh; khí NO không màu nhưng hóa nâu trong không khí.
Câu 3: Cho Cu (Z = 29), vị trí của Cu trong bảng tuần hoàn là
A. ô 29, chu kỳ 4, nhóm IB. B. ô 29, chu kỳ 4, nhóm IA.
C. ô 29, chu kỳ 4, nhóm VIIIB. D. ô 29, chu kỳ 4, nhóm IIB.
Hướng dẫn giải
Đáp án A
Cấu hình electron của Cu là 1s22s22p63s23p63d104s1
Vậy Cu ở ô 29 (Z = 29), chu kỳ 4 (do có 4 lớp electron), nhóm IB (1 electron hóa trị, nguyên tố d).
Câu 4: Trong các hợp chất, đồng có số oxi hóa phổ biến là
A. +1. B. +2. C. -2. D. +1 và +2.
Hướng dẫn giải
Đáp án D
Trong các hợp chất, đồng có số oxi hóa phổ biến là +1 và +2.
Câu 5: Hợp kim Cu – Zn (45% Zn) được gọi là
A. đồng thau. B. đồng thanh. C. đồng bạch. D. đuy ra.
Hướng dẫn giải
Đáp án A
Đồng thau là hợp kim Cu – Zn (45% Zn).
Câu 6: Cho 3,2 gam Cu tác dụng với 100ml dung dịch hỗn hợp (HNO3 0,8M + H2SO4 0,2M), sản phẩm khử duy nhất của HNO3 là NO. Thể tích khí NO (đktc) là
A. 0,672 lít. B. 0,336 lít.
C. 0,747 lít. D. 1,792 lít.
Hướng dẫn giải
Đáp án A
nCu = 3,2 : 64 = 0,05 mol
= 0,8.0,1 + 2.0,2.0,1 = 0,12 mol
= 0,8.0,1 = 0,08 mol
3Cu+ 8H++ 2NO3- → 3Cu2+ + 2NO + 4H2O
→ Sau phản ứng H+ hết đầu tiên
→ nNO = = = 0,03 mol
→ VNO = 0,03.22,4 = 0,672 lít.
Câu 7: Đồng thuộc ô 29 trong bảng tuần hoàn, vậy cấu hình electron của Cu+ và Cu2+ lần lượt là
A. [Ar]3d10; [Ar]3d9. B. [Ar]3d94s1; [Ar]3d84s1.
C. [Ar]3d94s1; [Ar]3d9. D. [Ar]3d84s2; [Ar]3d84s1.
Hướng dẫn giải
Đáp án A
Đồng có cấu hình electron là [Ar]3d104s1
→ Cấu hình electron của Cu+ và Cu2+ lần lượt là:[Ar]3d10; [Ar]3d9.
Câu 8: Tổng hệ số là các số nguyên, tối giản của tất cả các chất trong phương trình phản ứng giữa Cu với dung dịch HNO3 đặc, nóng là
A. 8. B. 10. C. 11. D. 9.
Hướng dẫn giải
Đáp án B
Cu + 4HNO3 Cu(NO3)2 + 2NO2 + 2H2O
Tổng hệ số = 1 + 4 + 1 + 2 + 2 = 10.
Câu 9: Nhận định nào sau đây là sai?
A. Đồng dẻo, dễ kéo sợi .
B. Đồng là kim loại có màu đen.
C. Đồng có thể dát mỏng hơn giấy viết từ 5 đến 6 lần.
D. Đồng dẫn nhiệt, điện tốt.
Hướng dẫn giải
Đáp án B
Đồng là kim loại có màu đỏ.
Câu 10: Cho Cu và dung dịch H2SO4 loãng tác dụng với chất X (một loại phân bón hóa học), thấy thoát ra khí không màu hóa nâu trong không khí. Mặt khác, khi X tác dụng với dung dịch NaOH thì có khí mùi khai thoát ra. Chất X là
A. amophot. B. ure. C. natri nitrat. D. amoni nitrat.
Hướng dẫn giải
Đáp án D
Amoni nitrat NH4NO3
3Cu + 8H+ + 2NO3- → 3Cu2+ + 2NO↑ + 4H2O
NH4+ + OH- → NH3↑ + H2O
Câu 11: Nhúng một thanh Cu vào dung dịch AgNO3, sau một thời gian lấy ra, rửa sạch, sấy khô, đem cân thì khối lượng thanh đồng thay đổi thế nào ?
A. Tăng. B. Giảm. C. Không thay đổi. D. không xác định được.
Hướng dẫn giải
Đáp án A
Giả sử có 1 mol Cu tham gia phản ứng
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag↓
nAg = 2nCu = 2 mol
→ Khối lượng thanh đồng tăng = 2.108 - 64 = 152 gam.
Câu 12: Cho Cu tác dụng với từng dung dịch sau: HCl (1), HNO3 (2), AgNO3 (3), Fe(NO3)2 (4), Fe(NO3)3 (5), Na2S (6). Cu phản ứng được với
A. 2, 3, 5, 6. B. 2, 3, 5. C. 1, 2, 3. D. 2, 3.
Hướng dẫn giải
Đáp án B
(2) 3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
(3) Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
(5) Cu + 2Fe(NO3)3 → 2Fe(NO3)2 + Cu(NO3)2
Câu 13: Hòa tan hết 3,04 gam hỗn hợp bột Fe và Cu trong dung dịch HNO3 loãng thu được 0,896 lít khí NO (đktc). Phần trăm của Fe và Cu trong hỗn hợp lần lượt là
A. 63,2% và 36,8%. B. 36,8% và 63,2%.
C. 50% và 50%. D. 36,2% và 63,8%.
Hướng dẫn giải
Đáp án B
Gọi số mol của Fe và Cu trong hỗn hợp lần lượt là x và y mol
→ mhh = 3,04 → 56x + 64y = 3,04. (1)
Áp dụng định luật bảo toàn electron ta có:
3.nFe + 2.nCu = 3.nNO → 3x + 2y = 0,12 (2)
Giải hệ phương trình (1) và (2) được x = 0,02 và y = 0,03
→ %mFe = = 36,8%
%mCu = 100 – 36,8 = 63,2%.
Câu 14: Cho m gam hỗn hợp X gồm Al, Cu vào dung dịch HCl dư, sinh ra 3,36 lít khí (ở đktc). Nếu cho m gam hỗn hợp X trên vào lượng dư axit nitric đặc, nguội, sinh ra 6,72 lít khí NO2 (sản phẩm khử duy nhất, ở đktc). Giá trị của m là
A. 10,5. B. 11,5. C. 12,3. D. 15,6.
Hướng dẫn giải
Đáp án C
Gọi số mol Al và Cu trong m gam hỗn hợp X lần lượt là a và b mol
Trường hợp 1: Cho X vào HCl dư, chỉ có Al phản ứng
2Al + 6HCl → 2AlCl3 + 3H2 (0,15 mol)
→ nAl = = = 0,1 mol
Trường hợp 2: Cho X vào HNO3 đặc, nguội Al bị thụ động, chỉ có Cu phản ứng
Cu + 4HNO3 → Cu(NO3)2 + 2NO2 (0,3 mol) + 2H2O
→ nCu = = 0,15 mol→ m = mAl + mCu = 0,1.27 + 0,15.64 = 12,3 gam.
Câu 15: Trong tự nhiên, nguyên tố đồng có hai đồng vị là 63Cu và 65Cu. Nguyên tử khối trung bình của đồng là 63,54. Phần trăm tổng số nguyên tử của đồng vị 65Cu là
A. 73%. B. 27%. C. 54%. D. 50%.
Hướng dẫn giải
Đáp án B
Gọi phần trăm số nguyên tử của 2 đồng vị 63Cu và 65Cu lần lượt là x và y (%)
→ x + y = 100 (1)
Nguyên tử khối trung bình của đồng là 63,54
→ = 63,54 (2)
Từ (1) và (2) ta đượcx = 73 và y = 27.
Câu 16: Kim loại Cu phản ứng được với dung dịch:
A. FeSO4. B. AgNO3 C. KNO3. D. HCl.
Hướng dẫn giải
Đáp án B
Kim loại Cu chỉ phản ứng với dung dịch AgNO3
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
Xem thêm các chương trình khác:
- Các dạng bài tập Tiếng Anh thông dụng nhất
- 3000 câu hỏi ôn tập môn Tiếng Anh có đáp án
- Toàn bộ kiến thức về cụm động từ | Định nghĩa và cách dùng
- 500 đoạn văn Tiếng Anh thông dụng nhất và cách làm
- 1000 câu hỏi ôn tập môn Công nghệ có đáp án
- 1000 câu hỏi ôn tập Giáo dục công dân
- 15000 câu hỏi ôn tập môn Toán có đáp án
- Wiki Toán | Khái niệm, định lí, tính chất, dạng bài, công thức
- Tuyển tập đề thi + chuyên đề ôn thi Toán Kangaroo các cấp độ (có đáp án 2024)
- 3000 câu hỏi ôn tập môn Vật lí có đáp án
- Tổng hợp Dạng bài - Công thức môn Vật lí
- 2000 câu hỏi ôn tập môn Tin học có đáp án
- 3000 câu hỏi ôn tập môn Lịch sử có đáp án
- 3000 câu hỏi ôn tập môn Địa lí có đáp án
- 2000 câu hỏi ôn tập môn Sinh học có đáp án
- Tổng hợp Dạng bài - Công thức môn Sinh học
- Tổng hợp về các tác giả văn học
- 3000 câu hỏi ôn tập môn Ngữ văn có đáp án
- Tổng hợp kiến thức Ngữ Văn
- Trò chơi Powerpoint | Game Powerpoint
- Tổng hợp bài thu hoạch BDTX Giáo viên mầm non (2024) theo Thông tư 12
- Tổng hợp bài thu hoạch BDTX Giáo viên tiểu học (2024)
- Tổng hợp bài thu hoạch BDTX Giáo viên THCS (2024)
- Tổng hợp bài thu hoạch BDTX Giáo viên THPT (2024)
