CuSO4 + NaOH → Cu(OH)2 + Na2SO4 | CuSO4 ra Cu(OH)2
CuSO4 + NaOH → Cu(OH)2 + Na2SO4 là phản ứng trao đổi. Bài viết này cung cấp đầy đủ thông tin về phương trình hóa học đã được cân bằng, điều kiện các chất tham gia phản ứng, hiện tượng (nếu có), ... Mời các bạn đón xem:
Phản ứng CuSO4 + NaOH → Cu(OH)2 + Na2SO4
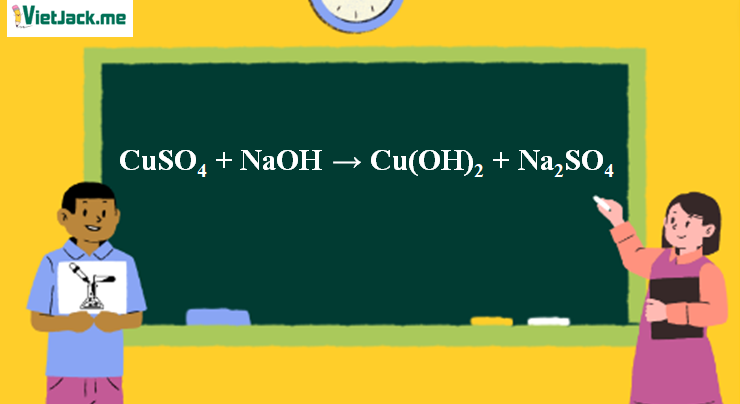
1. Phương trình phản ứng NaOH tác dụng CuSO4
CuSO4 + 2NaOH → Cu(OH)2↓ + Na2SO4
2. Điều kiện phản ứng xảy ra giữa CuSO4 và NaOH
Nhiệt độ thường
3. Phương trình ion rút gọn CuSO4 + NaOH
Phương trình phân tử CuSO4 + NaOH:
CuSO4+ 2NaOH → Cu(OH)2 + Na2SO4
Phương trình ion rút gọn:
Cu2+ + 2OH- → Cu(OH)2
4. Bản chất của các chất tham gia phản ứng
4.1. Bản chất của CuSO4 (Đồng sunphat)
CuSO4 có tính chất hóa học của muối tác dụng được với dung dịch bazo.
4.2. Bản chất của NaOH (Natri hidroxit)
NaOH là một bazo mạnh tác dụng được với muối.
5. Hiện tượng CuSO4 tác dụng với NaOH
Dung dịch sau phản ứng xuất hiện kết tủa màu xanh lam chính là Cu(OH)2
6. Mở rộng kiến thức về CuSO4
6.1. Tính chất vật lí và nhận biết
- Tính chất vật lí: Đồng (II) sulfat CuSO4 là chất bột màu trắng, hút mạnh hơi ẩm của không khí để tạo thành hiđrat CuSO4.5H2O màu lam. Lợi dụng tính chất này, người ta dùng CuSO4 khan để phát hiện nước ở lẫn trong hợp chất hữu cơ.
- Tan tốt trong nước.
- Nhận biết: Khi có mặt nước, CuSO4 tan dần, chuyển từ chất bột màu trắng sang dung dịch có màu xanh.
6.2. Tính chất hóa học
Có tính chất hóa học của muối.
- Tác dụng với dung dịch bazo:
CuSO4 + 2NaOH → Cu(OH)2 + Na2SO4
CuSO4 + Ba(OH)2 → Cu(OH)2 + BaSO4
- Tác dụng với muối:
BaCl2 + CuSO4 → CuCl2 + BaSO4
6.3. Điều chế
- Cho đồng (II) oxit tác dụng với H2SO4
CuO + H2SO4 → CuSO4 + H2
- Cho đồng phản ứng với H4SO4 đặc nóng
Cu + 2H2SO4 
6.4. Ứng dụng
- Trong thủy tinh,gốm
- Đồng(II) oxit được dùng trong vật liệu gốm để làm chất tạo màu sắc. Trong môi trường ôxy hoá bình thường, CuO không bị khử thành Cu2O và nó tạo màu xanh lá trong cho men.
- Oxit đồng là một flux khá mạnh. Nó làm tăng độ chảy loãng của men nung và tăng khả năng crazing do hệ số giãn nở nhiệt cao.
- CuO trong men bari/thiếc/natri cho màu xanh lam. K2O có thể làm cho men có CuO ngả sắc vàng.
7. Tính chất hoá học của NaOH
NaOH là một bazơ mạnh nó sẽ làm quỳ tím chuyển màu xanh, còn dung dịch phenolphtalein thành màu hồng. Một số phản ứng đặc trưng của Natri Hidroxit được liệt kê ngay dưới đây.
Phản ứng với axit tạo thành muối + nước:
NaOHdd + HCldd→ NaCldd + H2O
Phản ứng với oxit axit: SO2, CO2…
2 NaOH + SO2→ Na2SO3 + H2O
NaOH + SO2→ NaHSO3
Phản ứng với axit hữu cơ tạo thành muối và thủy phân este, peptit:
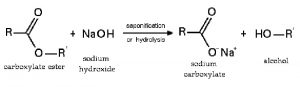
Phản ứng với muối tạo bazo mới + muối mới (điều kiện: sau phản ứng phải tạo thành chất kết tủa hoặc bay hơi):
2 NaOH + CuCl2→ 2NaCl + Cu(OH)2↓
Tác dụng với kim loại lưỡng tính:
2 NaOH + 2Al + 2H2O→ 2NaAlO2 + 3H2↑
2NaOH + Zn → Na2ZnO2 + H2↑
Tác dụng với hợp chất lưỡng tính:
NaOH + Al(OH)3 → NaAl(OH)4
2NaOH + Al2O3 → 2NaAlO2 + H2O
8. Bài tập vận dụng liên quan
Câu 1. Cho từ từ đến dư dung dịch NaOH vào dung dịch CuSO4, ta thấy:
A. Có kết tủa xanh, kết tủa không tan
B. Có kết tủa trắng và có khí bay ra
C. Tạo kết tủa trắng xanh sau chuyển thành kết tủa đỏ nâu.
D. Tạo kết tủa xanh sau đó kết tủa tan.
Lời giải:
2NaOH + CuSO4 → Na2SO4 + Cu(OH)2
=> Hiện tượng: Có kết tủa xanh, kết tủa không tan
Câu 2. Cho 3,2 gam Cu tác dụng với 100ml dung dịch hỗn hợp (HNO3 0,8M + H2SO4 0,2M), sản phẩm khử duy nhất của HNO3 là NO. Thể tích khí NO (đktc) là
A. 0,672 lít.
B. 0,336 lít.
C. 0,747 lít.
D. 1,792 lít.
Lời giải:
Câu 3. Cho các mô tả sau:
(1). Hoà tan Cu bằng dung dịch HCl đặc nóng giải phóng khí H2
(2). Ðồng dẫn nhiệt và dẫn điện tốt, chỉ thua Ag
(3). Ðồng kim loại có thể tan trong dung dịch FeCl3
(4). Có thể hoà tan Cu trong dung dịch HCl khi có mặt O2
(5). Ðồng thuộc nhóm kim loại nhẹ (d = 8,98 g/cm3)
(6). Không tồn tại Cu2O; Cu2S
Số mô tả đúng là:
A. 1.
B. 2.
C. 3 .
D. 4.
Lời giải:
Câu 5. Dung dịch muối đồng (II) sunfat (CuSO4) có thể phản ứng với dãy chất:
A. CO2, KOH, HNO3, Zn
B. H2SO4, AgNO3, Ba(OH)2, Ag
C. KOH, CaCl2, Fe, H2SO4
D. KOH, BaCl2, Zn, Al
Lời giải:
Dung dịch CuSO4 phản ứng được với: KOH, BaCl2, Zn, Al
CuSO4 + 2KOH → Cu(OH)2↓ + K2SO4
CuSO4 + BaCl2 → CuCl2 + BaSO4 ↓
CuSO4 + Zn → ZnSO4 + Cu
3CuSO4 + 2Al → Al2(SO4)3 + 3Cu
Câu 6. Hoà tan Na2CO3 vào hỗn hợp dung dịch axit HCl 0,5M và H2SO4 1,5M thì thu được một dung dịch A và 3,92 lit khí B (đktc). Cô cạn dung dịch A thu được 24,225 gam muối khan. Tính khối lượng Na2CO3 bị hoà tan
A. 37,1 gam
B. 18,55 gam
C. 24,7 gam
D. 27.83 gam
Lời giải:
Giả sử phải dùng V(lit) dung dịch gồm HCl 0,5M và H2SO4 1,5M.
Phương trình hóa học xảy ra:
Na2CO3+ 2HCl → 2NaCl + H2O + CO2
0,25V ← 0,5V → 0,5V → 0,25V (mol)
Na2CO3 + H2SO4 → Na2SO4 + H2O + CO2
1,5V ← 1,5V → 1,5V → 1,5V (mol)
Theo đầu bài ta có:
Số mol nCO2 = 0,25V + 1,5V = = 0,175 (mol) (1)
Khối lượng muối thu được: 58,5.0,5V + 142.1,5V = 24,22 (g) (2)
V = 0,1 (lít) = 100ml.
Số mol nNa2CO3= nCO2 = 0,175 mol
Vậy khối lượng Na2CO3 đã bị hoà tan:
mNa2CO3 = 0,175 . 106 = 18,55 gam
Câu 7. Cho 9,125 gam muối hiđrocacbon phản ứng hết với dung dịch H2SO4 (dư), thu được dung dịch chứa 7,5 gam muối sunfat trung hòa. Công thức của muối hiđrocacbon là:
A. NaHCO3
B. Mg(HCO3)2
C. Ba(HCO3)2
D. Ca(HCO3)2
Lời giải:
Gọi công thức muối hiđrocacbonat: M(HCO3)n
Phương trình: 2M(HCO3)n + nH2SO4 → M2(SO4)n+ 2nCO2 + 2nH2O
Ta thấy:
2 mol M(HCO3)n → 1 mol M2(SO4)n thì khối lượng giảm:
2,61n - 96n = 26n (g)
Vậy x mol M(HCO3)n → M2(SO4)n thì khối lượng giảm:
9,125 - 7,5 = 1,625 (g)
=> x = = (mol) => M + 61n = (9,125/0,125/n) = 73n => M = 12n
Cặp nghiệm phù hợp là: n = 2 và M = 24 (Mg)
Công thức của muối hiđrocacbonat là Mg(HCO3)2
Câu 8. Nhỏ từ từ từng giọt đến hết 30 ml dung dịch HCl 1M vào 100 ml dung dịch chứa Na2CO3 0,2M và NaOH 0,2M , sau phản ứng thu được số mol CO2 là:
A. 0,03
B. 0,01
C. 0,02
D. 0,015
Lời giải:
Na2CO3 + HCl → NaHCO3 + NaCl
0,02 → 0,02 → 0,02
NaHCO3 + HCl → NaCl + CO2 + H2O
0,01 0,01
⇒ nCO2 = 0,01mol
Xem thêm các phương trình hóa học khác:
Xem thêm các chương trình khác:
- Các dạng bài tập Tiếng Anh thông dụng nhất
- 3000 câu hỏi ôn tập môn Tiếng Anh có đáp án
- Toàn bộ kiến thức về cụm động từ | Định nghĩa và cách dùng
- 500 đoạn văn Tiếng Anh thông dụng nhất và cách làm
- 1000 câu hỏi ôn tập môn Công nghệ có đáp án
- 1000 câu hỏi ôn tập Giáo dục công dân
- 15000 câu hỏi ôn tập môn Toán có đáp án
- Wiki Toán | Khái niệm, định lí, tính chất, dạng bài, công thức
- Tuyển tập đề thi + chuyên đề ôn thi Toán Kangaroo các cấp độ (có đáp án 2024)
- 3000 câu hỏi ôn tập môn Vật lí có đáp án
- Tổng hợp Dạng bài - Công thức môn Vật lí
- 2000 câu hỏi ôn tập môn Tin học có đáp án
- 3000 câu hỏi ôn tập môn Lịch sử có đáp án
- 3000 câu hỏi ôn tập môn Địa lí có đáp án
- 2000 câu hỏi ôn tập môn Sinh học có đáp án
- Tổng hợp Dạng bài - Công thức môn Sinh học
- Tổng hợp về các tác giả văn học
- 3000 câu hỏi ôn tập môn Ngữ văn có đáp án
- Tổng hợp kiến thức Ngữ Văn
- Tuyển tập truyện dân gian, truyền thuyết, cổ tích,... Việt Nam
- Tổng hợp các đề đọc - hiểu có đáp án chi tiết
- Trò chơi Powerpoint | Game Powerpoint
- Tổng hợp bài thu hoạch BDTX Giáo viên mầm non (2025) theo Thông tư 12
- Tổng hợp bài thu hoạch BDTX Giáo viên tiểu học (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THCS (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THPT (2025)
