Zn + HNO3 → Zn(NO3)2 + N2O + N2 + H2O | Zn ra Zn(NO3)2
Zn + HNO3 → Zn(NO3)2 + N2O + N2 + H2O là phản ứng oxi hóa khử. Bài viết này cung cấp đầy đủ thông tin về phương trình hóa học đã được cân bằng, điều kiện các chất tham gia phản ứng, hiện tượng (nếu có), ... Mời các bạn đón xem:
Phản ứng Zn + HNO3 → Zn(NO3)2 + N2O + N2 + H2O

1. Phương trình phản ứng Zn tác dụng HNO3
23Zn + 56HNO3 → 23Zn(NO3)2 + 2N2O + 3N2+ 28H2O
2. Cân bằng phản ứng oxi hóa khử Zn + HNO3 → Zn(NO3)2 + N2O + N2 + H2O (biết tỉ lệ mol của N2O:N2 = 2:3)
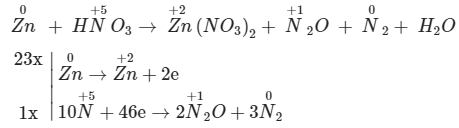
Vì tỉ lệ mol của N2O : N2 là 2 : 3
=> đặt 2 trước N2O và đặt 3 trước N2 sau đó tính tổng eletron nhận = 10.5 - 2.2.1 - 0 = 46
Chọn hệ số sao cho tổng electron cho = tổng electron nhận => nhân 23 ở quá trình cho eletron và nhân 1 ở quá trình nhận eletron
23Zn + 56HNO3 → 23Zn(NO3)2 + 2N2O + 3N2 + 28H2O
3. Điều kiện phản ứng Zn tác dụng HNO3
Nhiệt độ thường
4. Bản chất của các chất tham gia phản ứng
4.1. Bản chất của Zn (Kẽm)
- Trong phản ứng trên Zn là chất khử.
- Zn là kim loại hoạt động có tính khử mạnh tác dụng được với các axit.
4.2. Bản chất của HNO3 (Axit nitric)
- Trong phản ứng trên HNO3 là chất oxi hoá.
- Đây là một monoaxit mạnh, có tính oxi hóa mạnh có thể nitrat hóa nhiều hợp chất vô cơ.
5. Tính chất hoá học của Zn
Kẽm là kim loại hoạt động có tính khử mạnh Zn → Zn2+ + 2e
5.1. Tác dụng với phi kim
Zn tác dụng trực tiếp với nhiều phi kim.
2Zn + O2 → 2ZnO
Zn + Cl2 → ZnCl2
5.2. Tác dụng với axit
- Với các dung dịch axit HCl, H2SO4 loãng:
Zn + 2HCl → ZnCl2 + H2
- Với dung dịch HNO3, H2SO4 đặc:
Zn + 4HNO3 đ → Zn(NO3)2 + 2NO2 + 2H2O
5.3. Tác dụng với H2O
Phản ứng này hầu như không xảy ra vì trên bề mặt của kẽm có màng oxit bảo vệ.
5.4. Tác dụng với bazơ
Kẽm tác dụng với dung dịch bazơ mạnh: NaOH, KOH, Ca(OH)2....
Zn + 2NaOH + 2H2O → Na2[Zn(OH)4] + H2
5.5. Điều chế
Kẽm là nguyên tố được sử dụng phổ biến thứ 4, sau sắt, đồng, nhôm. Khoảng 70% lượng kẽm hiện nay đến từ việc khai thác quặng kẽm, phần còn lại sẽ từ hoạt động tái chế. 95% kẽm khai thác từ quặng sulfit. Trên thế giới các mỏ quặng kẽm tập trung nhiều tại Trung Quốc, Peru và Australia.
Quặng kẽm sẽ được nghiền nhỏ và trải qua nhiều công đoạn xử lý, tinh chế để thu được kim loại kẽm tinh khiết:
Chuyển kẽm sulfit thành kẽm oxit: 2 ZnS + 3 O2 → 2 ZnO + 2 SO2.
Khử kẽm oxit với cacbon hoặc CO ở 950 °C tạo kim loại kẽm ở dạng hơi. Hơi kẽm được thu hồi trong bình ngưng tụ:
2 ZnO + C → 2 Zn + CO2
2 ZnO + 2 CO → 2 Zn + 2 CO2.
Ngoài ra có thể khử ZnO bằng phương pháp sử dụng dung dịch H2SO4 sau đó điện phân thu kẽm kim loại:
ZnO + H2SO4 → ZnSO4 + H2O
2 ZnSO4 + 2 H2O → 2 Zn + 2 H2SO4 + O2
6. Tính chất hóa học của HNO3
- Axit nitric là một dung dịch nitrat hydro có công thức hóa học HNO3 . Đây là một axit khan, là một monoaxit mạnh, có tính oxy hóa mạnh có thể nitrat hóa nhiều hợp chất vô cơ, có hằng số cân bằng axit (pKa) = −2.
- Axit nitric là một monoproton chỉ có một sự phân ly nên trong dung dịch, nó bị điện ly hoàn toàn thành các ion nitrat NO3− và một proton hydrat, hay còn gọi là ion hiđroni.
H3O+ HNO3 + H2O → H3O+ + NO3-
- Axit nitric có tính chất của một axit bình thường nên nó làm quỳ tím chuyển sang màu đỏ.
- Tác dụng với bazo, oxit bazo, muối cacbonat tạo thành các muối nitrat
2HNO3 + CuO → Cu(NO3)2 + H2O
2HNO3 + Mg(OH)2 → Mg(NO3)2 + 2H2O
2HNO3 + CaCO3 → Ca(NO3)2 + H2O + CO2
- Axit nitric tác dụng với kim loại: Tác dụng với hầu hết các kim loại trừ Au và Pt tạo thành muối nitrat và nước .
Kim loại + HNO3 đặc → muối nitrat + NO + H2O ( to)
Kim loại + HNO3 loãng → muối nitrat + NO + H2O
Kim loại + HNO3 loãng lạnh → muối nitrat + H2
Mg(rắn) + 2HNO3 loãng lạnh → Mg(NO3)2 + H2 (khí)
- Nhôm, sắt, crom thụ động với axit nitric đặc nguội do lớp oxit kim loại được tạo ra bảo vệ chúng không bị oxy hóa tiếp.
- Tác dụng với phi kim (các nguyên tố á kim, ngoại trừ silic và halogen) tạo thành nito dioxit nếu là axit nitric đặc và oxit nito với axit loãng và nước, oxit của phi kim.
C + 4HNO3 đặc → 4NO2 + 2H2O + CO2
P + 5HNO3 đặc → 5NO2 + H2O + H3PO4
3C + 4HNO3 loãng → 3CO2 + 4NO + 2H2O
- Tác dụng với oxit bazo, bazo, muối mà kim loại trong hợp chất này chưa lên hóa trị cao nhất:
FeO + 4HNO3 → Fe(NO3)3 + NO2 + 2H2O
FeCO3 + 4HNO3 → Fe(NO3)3 + NO2 + 2H2O + CO2
- Tác dụng với hợp chất:
3H2S + 2HNO3 (>5%) → 3Skết tủa + 2NO + 4H2O
PbS + 8HNO3 đặc → PbSO4 kết tủa + 8NO2 + 4H2O
Ag3PO4 tan trong HNO3, HgS không tác dụng với HNO3.
- Tác dụng với nhiều hợp chất hữu cơ: Axit nitric có khả năng phá hủy nhiều hợp chất hữu cơ, nên sẽ rất nguy hiểm nếu để axit này tiếp xúc với cơ thể người.
7. Câu hỏi vận dụng liên quan
Câu 1. Cho 7,2 gam Mg tác dụng hết với dung dịch HNO3 (dư), sinh ra 4,48 lít khí X (sản phẩm khử duy nhất, ở đktc). Khí X là
A. N2O.
B. NO2.
C. N2.
D. NO.
Lời giải:
Câu 2. Dung dịch Amoniac có thể hòa tan được Zn(OH)2 là do:
A. Zn(OH)2 là hidroxit lưỡng tính
B. Zn(OH)2 là một bazơ ít tan
C. Zn(OH)2 có khả năng tạo thành phức chất tan
D. Amoniac là một hợp chất có cực và là một bazơ yếu.
Lời giải:
Câu 3. Hợp chất nào sau đây của nitơ không được tạo ra khi cho HNO3 tác dụng với kim loại?
A. N2O
B. NH4NO3
C. NO2
D. N2O5
Lời giải:
Câu 4. Cho phản ứng aFe + bHNO3 → cFe(NO3)3 + dNO + eH2O. Các hệ số a,b,c,d,e là những số nguyên đơn giản nhất. Tổng hệ số cân bằng tối giản trong phản ứng trên là
A. 8
B. 9
C. 7
D. 6
Lời giải:
Phương trình hóa học
Fe + 4HNO3 → Fe(NO3)3 + NO↑ + 2H2O
Tổng hệ số cân bằng trong phản ứng = a + b + c + d + e = 1 + 4 + 1 + 1 + 2
Câu 5. Cho bột sắt vào dung dịch bạc natrat dư, sau khi kết thúc thí nghiệm thu được dung dịch X gồm:
A. Fe(NO3)2, H2O
B. Fe(NO3)2, AgNO3
C. Fe(NO3)2, AgNO3
D. Fe(NO3)2, Fe(NO3)3, AgNO3
Lời giải:
Xem thêm các phương trình hóa học khác:
Xem thêm các chương trình khác:
- Các dạng bài tập Tiếng Anh thông dụng nhất
- 3000 câu hỏi ôn tập môn Tiếng Anh có đáp án
- Toàn bộ kiến thức về cụm động từ | Định nghĩa và cách dùng
- 500 đoạn văn Tiếng Anh thông dụng nhất và cách làm
- 1000 câu hỏi ôn tập môn Công nghệ có đáp án
- 1000 câu hỏi ôn tập Giáo dục công dân
- 15000 câu hỏi ôn tập môn Toán có đáp án
- Wiki Toán | Khái niệm, định lí, tính chất, dạng bài, công thức
- Tuyển tập đề thi + chuyên đề ôn thi Toán Kangaroo các cấp độ (có đáp án 2024)
- 3000 câu hỏi ôn tập môn Vật lí có đáp án
- Tổng hợp Dạng bài - Công thức môn Vật lí
- 2000 câu hỏi ôn tập môn Tin học có đáp án
- 3000 câu hỏi ôn tập môn Lịch sử có đáp án
- 3000 câu hỏi ôn tập môn Địa lí có đáp án
- 2000 câu hỏi ôn tập môn Sinh học có đáp án
- Tổng hợp Dạng bài - Công thức môn Sinh học
- Tổng hợp về các tác giả văn học
- 3000 câu hỏi ôn tập môn Ngữ văn có đáp án
- Tổng hợp kiến thức Ngữ Văn
- Tuyển tập truyện dân gian, truyền thuyết, cổ tích,... Việt Nam
- Tổng hợp các đề đọc - hiểu có đáp án chi tiết
- Trò chơi Powerpoint | Game Powerpoint
- Tổng hợp bài thu hoạch BDTX Giáo viên mầm non (2025) theo Thông tư 12
- Tổng hợp bài thu hoạch BDTX Giáo viên tiểu học (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THCS (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THPT (2025)
