Cu(NO3)2 → CuO + NO2 + O2 l Cu(NO3)2 ra CuO
Cu(NO3)2 → CuO + NO2 + O2 là phản ứng nhiệt phân. Bài viết này cung cấp đầy đủ thông tin về phương trình hóa học đã được cân bằng, điều kiện các chất tham gia phản ứng, hiện tượng (nếu có), ... Mời các bạn đón xem:
Phản ứng Cu(NO3)2  CuO + NO2 + O2↑
CuO + NO2 + O2↑
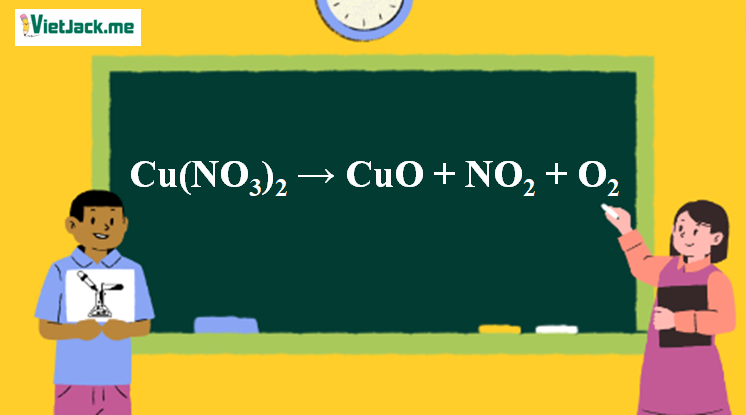
1. Phương trình phản ứng nhiệt phân Cu(NO3)2
2Cu(NO3)2  2CuO + 4NO2 + O2↑
2CuO + 4NO2 + O2↑
2. Điều kiện phản ứng nhiệt phân Cu(NO3)2 xảy ra
Nhiệt độ
3. Nhiệt phân hoàn toàn Cu(NO3)2 thu được các sản phẩm là
Nhiệt phân hoàn toàn NaNO3 thì chất rắn thu được CuO và 2 khí thoát ra NO2 và O2.
4. Bản chất của phản ứng nhiệt phân muối nitrat
Muối nitrat của các kim loại hoạt động mạnh (trước Mg): bị phân huỷ thành muối nitrit và oxi:
M(NO3)n → M(NO2)n + n/2O2
Muối nitrat của các kim loại từ Mg → Cu: bị phân huỷ thành oxit kim loại tương ứng, NO2 và O2:
2M(NO3)n → M2On + 2nNO2 + n/2O2
Muối nitrat của các kim loại kém hoạt động (sau Cu): bị phân huỷ thành kim loại tương ứng, NO2 và O2:
M(NO3)n → M + nNO2 + n/2O2
Một số phản ứng đặc biệt:
2Fe(NO3)2→ Fe2O3 + 4NO2 + 1/2O2
NH4NO3 → N2O + 2H2O
NH4NO2 → N2 + 2H2O
5. Mở rộng kiến thức về Cu(NO3)2
5.1. Định nghĩa
- Định nghĩa: Đồng (II) nitrat là một hợp chất vô cơ có bề ngoài là một chất rắn tinh thể màu xanh da trời.Muối khan của chất này tạo thành các tinh thể xanh lá cây-xanh da trời.
- Công thức phân tử: Cu(NO3)2
5.2. Tính chất vật lí
Là chất rắn, có màu xanh da trời. Thăng hoa trong chân không ở nhiệt độ 150-200 độC.
5.3. Tính chất hóa học
Có tính chất hóa học của muối.
Tác dụng với dung dịch bazơ:
Cu(NO3)2 + 2KOH → Cu(OH)2 + 2KCl
Cu(NO3)2 + Ba(OH)2 → Cu(OH)2 + Ba(NO3)2
5.4. Điều chế
Cho kim loại đồng tác dụng với dung dịch HNO3
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO +4H2O
5.5. Ứng dụng
Đối với màu sắc hấp dẫn của đồng nitrat, muối này được sử dụng làm phụ gia trong gốm sứ, trên bề mặt kim loại, trong một số pháo hoa và cả trong ngành dệt như một chất gắn màu.
Nó là một nguồn đồng ion tốt cho nhiều phản ứng, đặc biệt là những phản ứng xúc tác hữu cơ. Nó cũng tìm thấy việc sử dụng tương tự như các nitrat khác, như là thuốc diệt nấm, thuốc diệt cỏ hoặc làm chất bảo quản gỗ..
Một ứng dụng chính và sáng tạo nhất của nó là tổng hợp các chất xúc tác CuO, hoặc các vật liệu có phẩm chất nhạy sáng.
Nó cũng được sử dụng như một thuốc thử cổ điển trong các phòng thí nghiệm giảng dạy để hiển thị các phản ứng bên trong các tế bào bay hơi.
6. Bài tập vận dụng liên quan
Câu 1. Nhiệt phân hoàn toàn Cu(NO3)2 thu được các sản phẩm là
A. CuO, O2.
B. CuO, NO2, O2.
C. Cu, NO2, O2.
D. Cu2O, O2.
Lời giải:
Đáp án B
Nhiệt phân hoàn toàn Cu(NO3)2 thu được các sản phẩm là CuO, NO2, O2.
Phương trình nhiệt phân:
Cu(NO3)2 → CuO+ NO2 + O2
Câu 2. Nhiệt phân Fe(NO3)2sau khi các phản ứng xảy ra hoàn toàn, thu được sản phẩm gồm:
A. FeO, NO2, O2.
B. Fe2O3, NO2, O2.
C. Fe3O4, NO2, O2.
D. Fe, NO2, O2.
Lời giải:
Đáp án B
Nhiệt phân Fe(NO3)2 sau khi các phản ứng xảy ra hoàn toàn, thu được sản phẩm gồm Fe2O3, NO2, O2.
Phương trình nhiệt phân:
4Fe(NO3)2 → 2Fe2O3+ 8NO2 + O2
Câu 3. Nhiệt phân hoàn toàn a gam Cu(NO3)2 thu được 0,56 lít hỗn hợp khí X (đktc) và chất rắn Y. Giá trị của a là:
A. 37,6
B. 36,7
C. 3,76
D. 3,67
Lời giải:
Đáp án C
nhh= 1,12 : 22,4 = 0,05 mol
Cu(NO3)2→ CuO + 2NO2+ 1/2 O2
x → 2x → 1/2x
2x + 1/2x = 0,05 => x = 0,02 mol
=> a = 188.0,02 = 3,76 gam
Câu 4. Nhiệt phân KNO3 thu được sản phẩm:
A. K, NO2, O2.
B. KNO2, O2, NO2.
C. KNO2, O2.
D. K2O, N2O.
Lời giải:
Đáp án C
Nhiệt phân KNO3 thu được sản phẩm KNO2, O2.
Phương trình hóa học:
2KNO3 → 2KNO2 + O2
Câu 5. Khi nhiệt phân hoàn toàn KHCO3 thì sản phẩm của phản ứng nhiệt phân là:
A. KOH, CO2, H2.
B. K2O, CO2, H2O.
C. K2CO3, CO2, H2O.
D. KOH, CO2, H2O.
Lời giải:
Đáp án C
Khi nhiệt phân hoàn toàn KHCO3 thì sản phẩm của phản ứng nhiệt phân là K2CO3, CO2, H2O.
Phương trình hóa học:
2KHCO3 → K2CO3 + CO2 + H2O
Câu 6. Khi bị nhiệt phân, dãy muối nitrat nào sau đây đều cho sản phẩm là kim loại, khí nitơ đioxit và khí oxi?
A. Zn(NO3)2, NaNO3, Pb(NO3)2
B. Cu(NO3)2, CaNO3, NaNO3
C. Fe(NO3)2, CaNO3, NaNO3
D. Hg(NO3)2, AgNO3
Lời giải:
Đáp án D
Muối nitrat của các kim loại kém hoạt động (sau Cu): bị phân huỷ thành kim loại tương ứng, NO2 và O2.
M(NO3)n → M + nNO2 + n/2O2
Khi bị nhiệt phân, dãy muối nitrat nào đều cho sản phẩm là kim loại, khí nitơ đioxit và khí oxi là Hg(NO3)2, AgNO3
2Hg(NO3)2 → 2HgO + 4NO2 + O2
2AgNO3 → 2Ag + 2NO2 + O2
Câu 7. Cho các mệnh đề sau :
1) Các muối nitrat đều tan trong nước và đều là chất điện li mạnh.
2) Ion NO3- có tính oxi hóa trong môi trường axit.
3) Khi nhiệt phân muối nitrat rắn ta đều thu được khí NO2.
4) Hầu hết muối nitrat đều bền nhiệt.
Các mệnh đề đúng là:
A. (1), (2), (3).
B. (2) và (4).
C. (2) và (3).
D. (1) và (2).
Lời giải:
Đáp án D
Các mệnh đề đúng là: (1) và (2)
(3) sai vì muối nitrat của K, Na, Ba, Ca nhiệt phân không thu được khí NO2
(4) sai vì các muối nitrat hầu hết kém bền nhiệt
Câu 8. Trong các nhận xét dưới đây về muối nitrat của kim loại, nhận xét nào không đúng?
A. Tất cả các muối nitrat đều dễ tan trong nước
B. Các muối nitrat đều dễ bị phân huỷ bởi nhiệt
C. Các muối nitrat chỉ được sử dụng làm phân bón hoá học trong nông nghiệp
D. Các muối nitrat đều là chất điện li mạnh, khi tan trong nước phân li ra cation kim loại và anion nitrat
Lời giải:
Đáp án C
Câu 9. Cho các nhận định sau:
(1) Các muối nitrat đều tan trong nước và đều là chất điện li mạnh;
(2) Ion NO3- có tính oxi hóa trong môi trường axit;
(3) Khi nhiệt phân muối nitrat rắn ta đều thu được khí NO2;
(4) Hầu hết muối nitrat đều bền nhiệt.
Số mệnh đề đúng là:
A. 1
B. 2
C. 3
D. 4
Lời giải:
Đáp án B
Các mệnh đề đúng là: (1) và (2)
(3) sai vì muối nitrat của K, Na, Ba, Ca nhiệt phân không thu được khí NO2
(4) sai vì các muối nitrat hầu hết kém bền nhiệt
Câu 10. Dãy chất nào sau đây bị nhiệt phân hủy ở nhiệt độ cao
A. CaCO3, Zn(OH)2, KNO3, KMNO4
B. BaSO3, BaCl2, KOH, Na2SO4
C. AgNO3, Na2CO3, KCI, BaSO4
D. Fe(OH)3, Na2SO4, BaSO4, KCI
Lời giải:
Đáp án A
Phương trình phản ứng minh họa:
CaCO3 CaO + CO2
Zn(OH)2 ZnO + H2O
2KNO3 2KNO2+ O2
KMnO4 K2MnO4 + MnO2 + O2
Câu 11. Phân biệt 5 dung dịch riêng biệt sau: NH4NO3; (NH4)2SO4; NaCl; Mg(NO3)2 và FeCl2 bằng:
A. BaCl2
B. NaOH
C. Ba(OH)2
D. AgNO3
Lời giải:
Đáp án C
Sử dụng Ba(OH)2 để nhận biết 5 dung dịch trên
|
|
NH4NO3 |
(NH4)2SO4 |
NaCl |
Mg(NO3)2 |
FeCl2 |
|
Ba(OH)2 |
↑ mùi khai |
↑ mùi khai và ↓ trắng |
Không hiện tượng gì |
↓ trắng |
↓ trắng xanh |
Phương trình phản ứng xảy ra
2NH 4 NO 3 + Ba(OH) 2 → Ba(NO 3 ) 2 + 2NH 3 ↑ + 2H 2 O
(NH4)2 SO 4 + Ba(OH)2 → BaSO4 + 2NH3 + 2H2O
Ba(OH)2 + Mg(NO3)2 → Ba(NO3)2 + Mg(OH)2
Ba(OH)2 + FeCl2 → BaCl2 + Fe(OH)2↓
Xem thêm các phương trình hóa học khác:
Xem thêm các chương trình khác:
- Các dạng bài tập Tiếng Anh thông dụng nhất
- 3000 câu hỏi ôn tập môn Tiếng Anh có đáp án
- Toàn bộ kiến thức về cụm động từ | Định nghĩa và cách dùng
- 500 đoạn văn Tiếng Anh thông dụng nhất và cách làm
- 1000 câu hỏi ôn tập môn Công nghệ có đáp án
- 1000 câu hỏi ôn tập Giáo dục công dân
- 15000 câu hỏi ôn tập môn Toán có đáp án
- Wiki Toán | Khái niệm, định lí, tính chất, dạng bài, công thức
- Tuyển tập đề thi + chuyên đề ôn thi Toán Kangaroo các cấp độ (có đáp án 2025)
- 3000 câu hỏi ôn tập môn Vật lí có đáp án
- Tổng hợp Dạng bài - Công thức môn Vật lí
- 2000 câu hỏi ôn tập môn Tin học có đáp án
- 3000 câu hỏi ôn tập môn Lịch sử có đáp án
- 3000 câu hỏi ôn tập môn Địa lí có đáp án
- 2000 câu hỏi ôn tập môn Sinh học có đáp án
- Tổng hợp Dạng bài - Công thức môn Sinh học
- Tổng hợp về các tác giả văn học
- 3000 câu hỏi ôn tập môn Ngữ văn có đáp án
- Tổng hợp kiến thức Ngữ Văn
- Tuyển tập truyện dân gian, truyền thuyết, cổ tích,... Việt Nam
- Tổng hợp các đề đọc - hiểu có đáp án chi tiết
- Trò chơi Powerpoint | Game Powerpoint
- Tổng hợp bài thu hoạch BDTX Giáo viên mầm non (2025) theo Thông tư 12
- Tổng hợp bài thu hoạch BDTX Giáo viên tiểu học (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THCS (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THPT (2025)
- Tổng hợp thông tin, kiến thức chung
- Tiền tiểu học
