Ca(HCO3)2 → CaCO3 + CO2 + H2O | Ca(HCO3)2 ra CaCO3 | Ca(HCO3)2 ra CO2
Ca(HCO3)2 → CaCO3 + CO2 + H2O là phản ứng phân hủy. Bài viết này cung cấp đầy đủ thông tin về phương trình hóa học đã được cân bằng, điều kiện các chất tham gia phản ứng, hiện tượng (nếu có), ... Mời các bạn đón xem:
Phản ứng Ca(HCO3)2 → CaCO3 + CO2 + H2O
1. Phương trình phản ứng phân hủy Ca(HCO3)2
Ca(HCO3)2 CaCO3 + CO2 + H2O
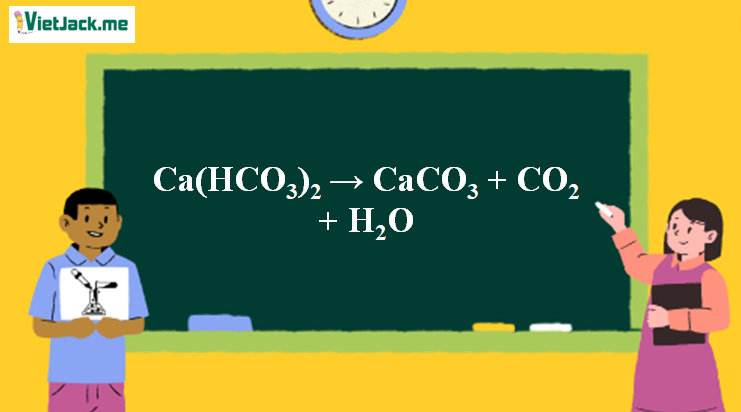
2. Điều kiện phản ứng xảy ra
Nhiệt độ
3. Bản chất nhiệt phân muối hiđrocacbonat và muối cacbonat
3.1. Nhiệt phân muối hiđrocacbonat (HCO3-)
Nhận xét: Tất cả các muối hiđrocacbonat đều kém bền nhiệt và bị phân huỷ khi đun nóng.
Phản ứng:
2M(HCO3)n → M2(CO3)n + nCO2 + nH2O
Ví dụ: 2NaHCO3 → Na2CO3 + CO2 + H2O
3.2. Nhiệt phân muối cacbonat (CO32-)
Nhận xét: Các muối cacbonat không tan (trừ muối amoni) đều bị phân huỷ bởi nhiệt.
Phản ứng:
M2(CO3)n → M2On + CO2
Ví dụ: CaCO3 → CaO + CO2
Lưu ý: Các phản ứng nhiệt phân muối cacbonat và hiđrocacbonat đều không thuộc phản ứng oxi hoá - khử.
Phản ứng nhiệt phân muối FeCO3trong không khí có phản ứng:
FeCO3 → FeO + CO2
4FeO + O2→ 2Fe2O3
4. Mở rộng kiến thức về Ca(HCO3)2
4.1. Tính chất vật lí & nhận biết
- Tính chất vật lí: Tồn tại trong dung dịch dưới dạng trong suốt, với hai ion Ca2+ và HCO3-.
- Nhận biết: sử dụng dung dịch axit HCl, thấy thoát ra khí không màu, không mùi:
Ca(HCO3)2 + 2HCl → CaCl2 + 2H2O + 2CO2
4.2. Tính chất hóa học
- Tác dụng với axit mạnh
Ca(HCO3)2 + H2SO4 → CaSO4 + 2H2O + 2CO2
- Tác dụng với dung dịch bazơ
Ca(HCO3)2 + Ca(OH)2 → 2CaCO3 + 2H2O
Ca(HCO3)2 + 2NaOH → CaCO3 + Na2CO3 + 2H2O
- Bị phân hủy bởi nhiệt độ:
Ca(HCO3)2 -to→ CaCO3 + H2O + CO2
4.3. Điều chế
Sục CO2 đến dư vào dung dịch Ca(OH)2
2CO2 + Ca(OH)2 → Ca(HCO3)2
5.Ứng dụng và công dụng của Ca(HCO3)2 trong ngành công nghiệp và sinh học là gì?
Ca(HCO3)2, còn được gọi là canxi bicacbonat hay canxi hidro cacbonat, là một muối của axit. Đây là một hợp chất có nhiều ứng dụng quan trọng trong ngành công nghiệp và sinh học. Dưới đây là một số ứng dụng và công dụng của Ca(HCO3)2:
1. Trong ngành công nghiệp thực phẩm: Ca(HCO3)2 được sử dụng rộng rãi làm chất điều chỉnh độ axit trong thực phẩm. Nó có khả năng điều chỉnh pH và ổn định độ axit, giúp tạo ra một môi trường lý tưởng cho quá trình sản xuất và bảo quản thực phẩm.
2. Trong ngành xử lý nước: Ca(HCO3)2 được sử dụng như một chất xử lý nước, để điều chỉnh và ổn định độ kiềm và pH của nước. Nó có khả năng giảm sự tạo cặn và mục nát trong các hệ thống cấp nước và hệ thống cơ sở xử lý nước.
3. Trong ngành nông nghiệp: Ca(HCO3)2 được sử dụng trong việc điều chỉnh độ kiềm và pH của đất. Nó có thể giúp cung cấp canxi cho cây trồng và cải thiện cấu trúc đất, tăng cường khả năng hấp thụ và sử dụng chất dinh dưỡng cho cây trồng.
4. Trong sinh học: Ca(HCO3)2 cũng được sử dụng trong nghiên cứu sinh học, đặc biệt là trong việc điều chỉnh pH và cung cấp canxi trong một số loại môi trường nuôi cấy tế bào, chẳng hạn như trong nuôi cấy tế bào mô phôi.
Qua đó, có thể thấy Ca(HCO3)2 có những ứng dụng quan trọng và đa dạng trong ngành công nghiệp và sinh học.
6. Bài tập vận dụng
Câu 1. Trong một cốc nước có chứa 0,01 mol Na+; 0,02 mol Ca2+; 0,01 mol Mg2+; 0,05 mol HCO3- và 0,02 mol Cl-. Nước trong cốc là:
A. Nước mềm
B. Nước cứng tạm thời
C. Nước cứng vĩnh cửu
D. Nước cứng toàn phần
Lời giải:
Đáp án: D
Câu 2. Thổi V lít khí CO2 (đktc) vào 100ml dung dịch Ca(OH)2 1M thu được 6 gam kết tủa. Lọc kết tủa đun nóng dung dịch lại thấy có kết tủa nữa. Tìm V?
A. 3,136 lít
B. 6,272 lít
C. 1,568 lít
D. 4,704 lít
Lời giải:
Đáp án: A
Giải thích:
nCaCO3 = 6/100 = 0,06 mol
Do đun nóng lại thu được thêm kết tủa => nên có Ca(HCO3)2
nCaCO3 tạo thêm là 4/100 = 0,04 mol
CO2 + Ca(OH)2 → CaCO3 + H2O
0,06 → 0,06 → 0,06
2CO2 + Ca(OH)2 → Ca(HCO3)2
Ca(HCO3)2→ CaCO3+ CO2 + H2O
0,04 0,04
→ nCO2 ở phản ứng 2 là 0,04.2 =0 ,08 mol
→ nCO2= 0,06 + 0,08 = 0,14 mol
→ V = 0,14.22,4 = 3,136 lít
Câu 3. Hấp thụ hoàn toàn 3,36 lít khí CO2 (đktc) vào 100ml dung dịch Ba(OH)21M, thu được m gam kết tủa. Giá trị của m là
A. 1,97.
B. 3,94.
C. 19,7.
D. 9,85.
Lời giải:
Đáp án: D
Giải thích:
CO2 = 3,36/22,4 = 0,15 (mol);
nBa(OH)2 = 0,1.1 = 0,1 (mol)
Ta có: 1 < nCO2/nBa(OH)2= 0,15/0,1 =1,5 < 2
=> Tạo 2 muối BaCO3 và Ba(HCO3)2 cả CO2 và Ba(OH)2 đều phản ứng hết
CO2 + Ba(OH)2 → BaCO3↓ + H2O
a ← a ← a (mol)
2CO2 + Ba(HCO3)2 → Ba(HCO3)2
2b ← b ← b (mol)
Ta có:
∑nBa(OH)2 = a + b = 0,1
∑nCO2 = a + 2b = 0,15
a = 0,05
b = 0,05
=> mBaCO3= 0,05.197 = 9,85 (g)
Câu 4. Nung hỗn hợp X gồm FeCO3 và BaCO3 trong không khí đến khối lượng không đổi, thu được chất rắn Y và V lít CO2 (đktc). Hòa tan Y vào H2O dư thu được dung dịch Z và 8 gam chất rắn không tan. Hấp thụ hết V lít khí CO2 vào Z thu được 9,85 gam kết tủa. Khối lượng của FeCO3 và BaCO3 trong hỗn hợp ban đầu?
A. 11,6 gam, 29,77g
B. 23,2 gam, 29,77 gam
C. 23,2 gam, 32,45 gam
D. 11,6 gam, 24, 67 gam
Lời giải:
Đáp án: A
Giải thích:
4FeCO3 + O2 → 2Fe2O3 + 4CO2
x………………→ 0,5x ……. x
BaCO3 → BaO + CO2
y …………..→.. y……y
nCO2 = x + y
Chất rắn Y gồm: Fe2O3 và BaO
Y + H2O dư: Chất rắn không tan là Fe2O3
→ 160.0,5x = 8 → x = 0,1 mol → nCO2= 0,1 + y
BaO + H2O → Ba(OH)2
y.…………..→……..y
Dung dịch Z là dung dịch Ba(OH)2
Ba(OH)2 + CO2 → BaCO3+ H2O
y……. →…… y…… y
→ Số mol CO2 dư để hòa tan kết tủa BaCO3 là: (0,1 + y) – y =0,1 mol
CO2 + BaCO3 + H2O → Ba(HCO3)2
0,1…→…..0,1…………………..0,1
nBaCO3 = y - 0,1 = 9,85/197 = 0,05 mol → y = 0,15 mol
mFeCO3= 0,1.116 = 11,6g
mBaCO3 = 0,15.197 = 29,77g
Câu 5. Nhận định nào sau đây về muối cacbonat là đúng ? Tất cả muối cacbonat đều
A. bị nhiệt phân tạo ra oxit kim loại và cacbon dioxit
B. không tan trong nước
C. tan trong nước.
D. bị nhiệt phân trừ muối cacbonat của kim loại kiềm.
Lời giải:
Đáp án: D
Giải thích:
Muối cacbonat của kim loại kiềm, amoni và đa số các muối hidrocacbonat dễ tan trong nước. các muối của kim loại không tan trong nước, ví dụ: BaCO3; KCO3.
+ Muối cacbonat trung hòa của kim loại kiềm bền với nhiệt. Muối cacbonat trung hòa của kim loại khác cũng như muối hidrocacbonat bị nhiệt phân hủy.
Ví dụ: BaCO3 → BaO + CO2 hay
2KHCO3 → K2CO3 + CO2 + H2O
Câu 6. Khi cho từ từ dung dịch K2CO3 vào dung dịch HCl khuấy đều, hiện tượng xảy ra là
A. xuất hiện chất khí bay ra ngay khi cho K2CO3vào
B. sau 1 thời gian thấy xuất hiện chất khí bay ra, dung dịch trong suốt
C. không có khí thoát ra
D. có khí thoát ra và xuất hiện kết tủa
Lời giải:
Đáp án: A
Giải thích:
Phương trình hóa học: K2CO3 + 2HCl → 2KCl + CO2 + H2O.
Khi cho từ từ dung dịch K2CO3 vào dung dịch HCl khuấy đều, hiện tượng xảy ra là xuất hiện chất khí bay ra ngay khi cho K2CO3 vào
Câu 7. Nhiệt phân hoàn toàn 81 gam Ca(HCO3)2 thu được V lít khí CO2 (đktc). Giá trị của V là:
A. 5,6.
B. 33,6.
C. 11,2.
D. 22,4.
Lời giải:
Đáp án: D
Giải thích:
nCa(HCO3)2 = 81: 162 = 0,5 mol
Ca(HCO3)2 → CaCO3 + CO2 + H2O
0,5 → 0,5 → 0,5 mol
CaCO3 → CaO + CO2
0,5 → 0,5 mol
=> nCO2 = 0,5 + 0,5 = 1 mol
=> VCO2 = 1.22,4 = 22,4 lít
Câu 8. Hỗn hợp rắn A gồm Ca(HCO3); CaCO3; NaHCO3; Na2CO3. Nung A đến khối lượng không đổi được chất rắn B gồm:
A. CaCO3 và Na2O.
B. CaO và Na2O.
C. CaCO3 và Na2CO3.
D. CaO và Na2CO3.
Lời giải:
Đáp án: D
Giải thích:
Ca(HCO3)2 → CaO + 2CO2 + H2O
CaCO3 → CaO + CO2
2NaHCO3→ Na2CO3 + CO2 + H2O
Câu 9. Chất nào sau đây được dùng để làm mềm nước cứng vĩnh cửu?
A. Na2CO3 và Na3PO4
B. Na2SO4 và Na3PO4.
C. HCl và Na2CO3.
D. HCl và Ca(OH)2.
Lời giải:
Đáp án: A
Câu 10. Nhiệt phân hoàn toàn 16,2 gam Ca(HCO3)2, thu được V lít khí CO2 ở đktc. Giá trị của V là
A. 2,24
B. 3,36
C. 4,48
D. 5,6
Lời giải:
Đáp án: C
Giải thích:
Ca(HCO3)2 → CaO + 2CO2↑ + H2O
→ nCO2 = 2nCa(HCO3)2 = 2.16,2162 = 0,2mol→V = 4,48
Xem thêm các phương trình phản ứng hóa học khác:
Xem thêm các chương trình khác:
- Các dạng bài tập Tiếng Anh thông dụng nhất
- 3000 câu hỏi ôn tập môn Tiếng Anh có đáp án
- Toàn bộ kiến thức về cụm động từ | Định nghĩa và cách dùng
- 500 đoạn văn Tiếng Anh thông dụng nhất và cách làm
- 1000 câu hỏi ôn tập môn Công nghệ có đáp án
- 1000 câu hỏi ôn tập Giáo dục công dân
- 15000 câu hỏi ôn tập môn Toán có đáp án
- Wiki Toán | Khái niệm, định lí, tính chất, dạng bài, công thức
- Tuyển tập đề thi + chuyên đề ôn thi Toán Kangaroo các cấp độ (có đáp án 2024)
- 3000 câu hỏi ôn tập môn Vật lí có đáp án
- Tổng hợp Dạng bài - Công thức môn Vật lí
- 2000 câu hỏi ôn tập môn Tin học có đáp án
- 3000 câu hỏi ôn tập môn Lịch sử có đáp án
- 3000 câu hỏi ôn tập môn Địa lí có đáp án
- 2000 câu hỏi ôn tập môn Sinh học có đáp án
- Tổng hợp Dạng bài - Công thức môn Sinh học
- Tổng hợp về các tác giả văn học
- 3000 câu hỏi ôn tập môn Ngữ văn có đáp án
- Tổng hợp kiến thức Ngữ Văn
- Tuyển tập truyện dân gian, truyền thuyết, cổ tích,... Việt Nam
- Tổng hợp các đề đọc - hiểu có đáp án chi tiết
- Trò chơi Powerpoint | Game Powerpoint
- Tổng hợp bài thu hoạch BDTX Giáo viên mầm non (2025) theo Thông tư 12
- Tổng hợp bài thu hoạch BDTX Giáo viên tiểu học (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THCS (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THPT (2025)
