NaOH + AlCl3 dư → Al(OH)3 + NaCl
NaOH + AlCl3 dư → Al(OH)3 + NaCl là phản ứng trao đổi. Bài viết này cung cấp đầy đủ thông tin về phương trình hóa học đã được cân bằng, điều kiện các chất tham gia phản ứng, hiện tượng (nếu có), ... Mời các bạn đón xem:
Phản ứng: NaOH + AlCl3 dư → Al(OH)3 + NaCl
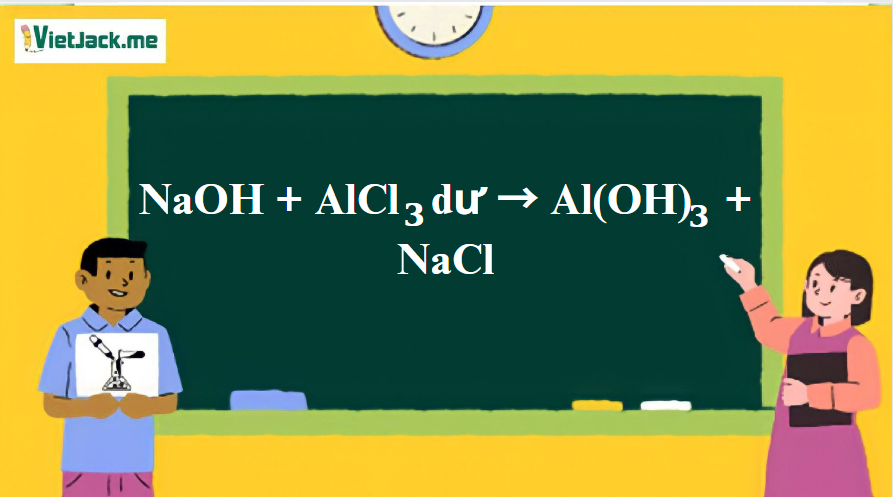
1. Phương trình phản ứng giữa NaOH và AlCl3 dư
3NaOH + AlCl3 → Al(OH)3↓ + 3NaCl
2. Cách tiến hành phản ứng cho NaOH tác dụng với AlCl3 dư
- Nhỏ từ từ đến dư AlCl3 vào ống nghiệm chứa sẵn 1 – 2 ml dung dịch NaOH.
3. Hiện tượng phản ứng cho NaOH tác dụng với AlCl3 dư
- Xuất hiện kết tủa keo trắng.
4. Bản chất của các chất tham gia phản ứng
4.1 Bản chất của NaOH
NaOH là một bazo mạnh nên tác dụng được với muối AlCl3.
4.2 Bản chất của AlCl3
AlCl3 mang đầy đủ tính chất hoá học của muối nên tác dụng được với dung dịch bazo.
5. Tính chất hóa học của NaOH
5.1 Làm đổi màu chất chỉ thị
Dung dịch NaOH làm quỳ tím chuyển thành màu xanh.
Dung dịch NaOH làm phenolphthalein không màu chuyển sang màu đỏ, đổi màu methyl da cam thành màu vàng.
5.2 Natri hidroxit tác dụng với oxit axit
Khi tác dụng với axit và oxit axit trung bình, yếu thì tùy theo tỉ lệ mol các chất tham gia mà muối thu được có thể là muối axit, muối trung hòa hay cả hai.
Phản ứng với oxit axit: NO2, SO2, CO2...
Ví dụ:
2NaOH + SO2 → Na2SO3 + H2O
NaOH + SO2→ NaHSO3
2NaOH + 2NO2→ H2O + NaNO2 + NaNO3 (tạo 2 muối )
NaOH + CO2 → NaHCO3
2NaOH + CO2→ Na2CO3 + H2O
3NaOH + P2O5 → Na3PO4↓ + 3H2O
NaOH + SiO2 → Na2SiO3
Phản ứng với SiO2 là phản ứng ăn mòn thủy tinh vì thế khi nấu chảy NaOH, người ta dùng các dụng cụ bằng sắt, niken hay bạc mà không dùng thủy tinh để chứa NaOH.
5.3 Natri hidroxit tác dụng với axit
Là một bazơ mạnh nên tính chất đặc trưng của NaOH là tác dụng với axit tạo thành muối tan và nước. Phản ứng này còn gọi là phản ứng trung hòa.
Ví dụ:
NaOH + HCl → NaCl+ H2O
NaOH + HNO3→ NaNO3+ H2O
2NaOH + H2SO4 → Na2SO4 + 2H2O
3NaOH + H3PO4→ Na3PO4 + 3H2O
2NaOH + H2CO3 → Na2CO3 + 2H2O
5.4 Natri hidroxit tác dụng với muối
Natri hidroxit tác dụng với dung dịch muối tạo thành muối mới và bazơ mới.
Điều kiện để có phản ứng xảy ra: Muối tạo thành phải là muối không tan hoặc bazơ tạo thành phải là bazơ không tan.
Ví dụ:
2NaOH + CuSO4 → Na2SO4 + Cu(OH)2⏐↓
NaOH + MgSO4→ Mg(OH)2 + Na2SO4
2NaOH + MgCl2 → 2NaCl + Mg(OH)2
FeCl3 + 3NaOH → Fe(OH)3+ 3NaCl
Cu(NO3)2 + 2NaOH → Cu(OH)2 + 2NaNO3
2NaOH + FeSO4 → Na2SO4 + Fe(OH)2↓ nâu đỏ
5.5 Natri hidroxit tác dụng với một số phi kim như Si, C, P, S, Halogen
Si + 2NaOH + H2O → Na2SiO3 + 2H2↑
C + NaOH nóng chảy → 2Na + 2Na2CO3 + 3H2↑
4P trắng + 3NaOH + 3H2O → PH3↑ + 3NaH2PO2
Cl2+ 2NaOH → NaCl + NaClO + H2O
3Cl2 + 6NaOH → NaCl + NaClO3 + 3H2O
5.6 Dung dịch NaOH có khả năng hoà tan một hợp chất của kim loại lưỡng tính Al, Zn, Be Sn Pb
Ví dụ: Al, Al2O3, Al(OH)3
2NaOH + 2Al + 2H2O → 2NaAlO2 + 3H2↑
2NaOH + Al2O3→ 2NaAlO2 + H2O
NaOH + Al(OH)3→ NaAlO2 + 2H2O
Chất được tạo ra trong dung dịch có thể chứa ion Na[Al(OH)4], hoặc có thể viết
Al(OH)3 + NaOH → Na[Al(OH)4]
Tương tự, NaOH có thể tác dụng với kim loại Be, Zn, Sb, Pb, Cr và oxit và hiđroxit tương ứng của chúng.
6. Ứng dụng của NaOH
- Sản xuất các sản phẩm làm sạch và khử khuẩn. ...
- Ứng dụng trong ngành Y học – Dược phẩm. ...
- Ứng dụng trong chế tạo nguyên liệu, năng lượng. ...
- Sử dụng trong xử lý nước. ...
- Ứng dụng trong chế biến thực phẩm. ...
- Ứng dụng trong sản phẩm gỗ và giấy. ...
- Ứng dụng trong sản xuất công nghiệp khác.
7. Bài toán về sự lưỡng tính của Al(OH)3
Al(OH)3 là hiđroxit lưỡng tính:
+ Tác dụng với axit mạnh: Al(OH)3 + 3HCl → AlCl3 + 3H2O
+ Tác dụng với dung dịch kiềm mạnh: Al(OH)3 + KOH → KAlO2 + 2H2O
Hay: Al(OH)3 + KOH → K[Al(OH)4]
Phương trình ion thu gọn: Al(OH)3 + OH- → AlO2- + 2H2O
6.1: Cho dung dịch OH- tác dụng với dung dịch Al3+
Phương pháp giải:
Quá trình phản ứng
Al3++3OH−→Al(OH)3
Al(OH)3+OH−→AlO−2+2H2O
Cách 1: Tính theo phương trình hóa học.
Cách 2: Xét tỉ lệ k=nOH−nAl3+
Nếu k ≤ 3 thì khi đó nAl(OH)3=nOH−3
Nếu 3 < k < 4 thì khi đó nAl(OH)3=4nAl3+−nOH−
Cách 3: Ta có thể dùng sơ đồ phản ứng kết hợp với phương pháp bảo toàn nguyên tố, bảo toàn điện tích để giải nhanh.
6.2: Cho từ từ dung dịch H+ vào dung dịch AlO−2
Phương pháp giải:
Cách 1: Tính theo phương trình hóa học nối tiếp
Khi cho muối aluminat tác dụng với dung dịch axit xảy ra phản ứng:
AlO−2+H++H2O→Al(OH)3
Nếu H+ dư thì xảy ra tiếp:
Al(OH)3+3H+→Al3++3H2O
Chú ý: Nếu trong dung dịch có OH- thì H+ sẽ phản ứng với OH- trước, sau đó mới phản ứng với AlO−2
Cách 2: Xét phương trình hóa học song song
AlO−2+H++H2O→Al(OH)3(1)
AlO−2+4H+→Al3++2H2O(2)
Nếu nH+≤nAlO−2 thì chỉ xảy ra (1), khi đó: nAl(OH)3=nH+
Nếu nH+>nAlO−2 thì xảy ra cả (1) và (2), khi đó (nH+=nAl(OH)3+4nAl3+nAlO−2=nAl(OH)3+nAl3+)
Cách 3: Dùng bảo toàn nguyên tố.
8. Bài tập vận dụng liên quan
Câu 1: Cho 100 ml dung dịch AlCl3 0,15M vào 250 ml dung dịch NaOH 0,2M, sau khi phản ứng xảy ra hoàn toàn, thu được m gam kết tủa. Giá trị của m là
A. 1,56 B. 0,78
C. 1,17 D. 1,30
Hướng dẫn giải
Đáp án B
nAlCl3=0,015mol→nAl3+=0,015mol
nNaOH=0,05mol→nOH−=0,05mol
Phương trình hóa học:
Al3++3OH−→Al0,015→0,045→0,015
Sau phản ứng, OH- dư: 0,05 – 0,045 = 0,005 mol
Al+OH−→AlO−2+2H2O0,005←0,005
Sau phản ứng: nAl(OH)3=0,015−0,005=0,01mol
→ mkết tủa = 0,01.78 = 0,78 gam
Câu 2: Cho từ từ đến hết 100 ml dung dịch NaOH 1,5M vào 50 ml dung dịch AlCl3 1,5M, sau khi các phản ứng xảy ra hoàn toàn thu được m gam kết tủa. Giá trị của m là
A. 12,4. B. 7,8.
C. 15,6. D. 3,9.
Hướng dẫn giải
Đáp án D
nNaOH=0,15mol→nOH−=0,15mol
nAlCl3=0,075mol→nAl3+=0,075mol
Xét tỉ lệ nOH−nAl3+=2<3
Khi đó nAl(OH)3=nOH−3=0,153=0,05mol→m=mAl(OH)3=0,05.78=3,9gam
Câu 3: Cho 200 ml dung dịch HCl 2M vào 100 ml dung dịch gồm NaOH 0,6M và NaAlO2 1M, phản ứng xong thu được m gam kết tủa. Giá trị của m là
A. 7,80. B. 3,90.
C. 3,12. D. 1,56.
Hướng dẫn giải
Đáp án D
nHCl=0,4mol→nH+=0,4mol
nNaOH=0,06mol→nOH−=0,06mol
nNaAlO2=0,1mol→nAlO−2=0,1mol
Phương trình hóa học:
OH−+H+→H2O0,06→0,06
AlO−2+H++H2O→Al0,1→0,1→0,1
Al+3H+→Al3++3H2O0,08←0,24
Ta có: nAl(OH)3du=0,1−0,08=0,02mol→mAl(OH)3du=0,02.78=1,56gam
Câu 4: Cho 100 ml dung dịch HCl 0,5M vào 100 ml dung dịch NaAlO2 1M, phản ứng xong thu được m gam kết tủa. Giá trị của m là
A. 3,90 B. 7,80.
C. 5,85. D. 4,68.
Hướng dẫn giải
Đáp án A
nHCl=0,05mol→nH+=0,05mol
nNaAlO2=0,1mol→nAlO−2=0,1mol
Ta thấy nH+<nAlO−2 nên khi đó nAl(OH)3=nH+=0,05mol
→m=mAl(OH)3=0,05.78=3,9gam
Câu 5:Dùng hóa chất nào sau đây để phân biệt Zn(NO3)2 và Al(NO3)3 ?
A.Dung dịch NaOHB.Dung dịch Ba(OH)2
C.Dung dịch NH3D.Dung dịch nước vôi trong
Hướng dẫn giải
Đáp án C
Khi cho NH3 vào 2 dung dịch cả 2 dung dịch đều xuất hiện kết tủa hiđroxit, nhưng Zn(OH)2 tạo thành có khả năng tạo phức với NH3 nên kết tủa lại tan, còn với Al(OH)3 không tan trong NH3
Al(NO3)3 + 3NH3 + 3H2O → Al(OH)3↓ + 3NH4NO3
Zn(NO3)2 + 2NH3 + 2H2O → Zn(OH)2↓ + 2NH4NO3
Dung dịch amoniac có khả năng hòa tan hiđroxit hay muối ít tan của một số kim loại (Ag, Cu, Zn), tạo thành các dung dịch phức chất.
Câu 6: Hiện tượng nào xảy ra khi cho từ từ đến dư dung dịch NaOH vào dung dịch AlCl3?
A. Ban đầu không thấy hiện tượng, sau đó kết tủa xuất hiện
B. Xuất hiện kết tủa keo trắng ngay lập tức, sau đó kết tủa tan dần
C. Ban đầu không thấy hiện tượng, sau đó kết tủa xuất hiện, rồi tan dần.
D. Xuất hiện kết tủa keo trắng ngay lập tức và không tan.
Hướng dẫn giải
Đáp án B
Ban đầu có kết tủa keo trắng ngay lập tức
3NaOH + AlCl3 → Al(OH)3↓ + 3NaCl
Khi NaOH dư, kết tủa tan dần
NaOH + Al(OH)3 → NaAlO2 + 2H2O
Câu 7:Nhôm hiđroxit thu được từ cách làm nào sau đây?
A. Cho dư dung dịch HCl vào dung dịch natri aluminat.
B. Thổi dư CO2 vào dung dịch natri aluminat.
C. Cho dư dung dịch NaOH vào dung dịch AlCl3.
D. Cho Al2O3 tác dụng với nướC.
Hướng dẫn giải
Đáp án B
Nhôm hiđroxit thu được khi thổi dư CO2 vào dung dịch natri aluminat
Phương trình phản ứng:
NaAlO2 + CO2 + 2H2O -> Al(OH)3↓ + NaHCO3.
Câu 8: Cho hỗn hợp X gồm Al và Al2O3 có tỉ lệ khối lượng tương ứng là 0,18 : 1,02. Cho X tan trong dung dịch NaOH vừa đủ thu được dung dịch Y và 0,672 lít khí H2 (đktc). Cho Y tác dụng với 200 ml dung dịch HCl được kết tủa Z. Nung Z ở nhiệt độ cao đến khối lượng không đổi được 3,57g chất rắn. Nồng độ mol của dung dịch HCl là
A. 0,35M hoặc 0,45M. B. 0,07M hoặc 0,11M.
C. 0,07M hoặc 0,09M. D. 0,35M hoặc 0,55M.
Hướng dẫn giải
Đáp án D
nH2= 0,03
Bảo toàn electron: 3.nAl = 2.nH2
→ nAl = 0,02 → mAl = 0,54g
Al và Al2O3 có tỉ lệ khối lượng tương ứng là 0,18 : 1,02
→mAl2O3= 0,540,18.1,02=3,06g
→nAl2O3bđ = 0,03 mol
Bảo toàn nguyên tố Al →nNaAlO2 = nAl + 2. nAl2O3 bđ = 0,08 mol
nAl2O3thu được = 3,57 : 102 = 0,035 mol
nAl(OH)3= 0,07 mol
Trường hợp 1: NaAlO2 + HCl + H2O → Al(OH)3 + NaCl
nHCl = nAl(OH)3 = 0,07 mol
→ CM HCl = 0,070,2= 0,35M
Trường hợp 2:
NaAlO2+HCl+H2O→Al(OH)3+NaCl0,07←0,07←0,07mol
NaAlO2+4HCl→AlCl3+NaCl+2H2O(0,08−0,07)→0,04mol
→ nHCl = 0,11 mol
→ CM HCl = 0,110,2 = 0,55M
Câu 9:Để phân biệt dung dịch AlCl3 và dung dịch KCl ta dùng dung dịch
A.NaOH. B. HCl.
C.NaNO3 D. H2SO4.
Hướng dẫn giải
Đáp án A
Trích mẫu thử của hai dung dịch ra hai ống nghiệm có đánh số.
Nhỏ NaOH dư vào từng ống nghiệm
- Xuất hiện kết tủa trắng sau đó kết tủa tan: AlCl3
AlCl3 + 3NaOH → Al(OH)3↓ + 3NaCl
Al(OH)3 + NaOH → NaAlO2 + 2H2O
- Không có hiện tượng gì: KCl
Câu 10: Cho 3,24 gam Al2(SO4)3 phản ứng với 25 ml dung dịch NaOH thu được 0,78 gam kết tủa trắng. Nồng độ mol của dung dịch NaOH đã dùng là
A. 1,2M và 2,4M. B. 1,2M.
C. 2,8M. D. 1,2M và 2,8M.
Hướng dẫn giải
Đáp án D
nAl2(SO4)3 = 0,01 mol → nAl3+ = 2.nAl2(SO4)3 = 0,02 mol
mà nAl(OH)3= 0,7878 = 0,01 mol < 0,02 nên có 2 trường hợp
Trường hợp 1: nOH−min = 3.nAl(OH)3 = 0,03 mol
→ CM NaOH = 0,030,025 = 1,2M.
Trường hợp 2: nOH−max = 4.nAl3+ – nAl(OH)3 = 4.0,02 – 0,01 = 0,07 mol
→ CM NaOH = 0,070,025 = 2,8M
Câu 11:
Hiện tượng thu được khi nhỏ từ từ NaOH đến dư vào dung dịch AlCl3 là:
A. Có kết tủa keo trắng xuất hiện
B. Hiện tượng xuất hiện kết tủa keo trắng, sau đó xuất hiện hiện tượng kết tủa tan
C. Xuất hiện hiện tượng kết tủa nâu đỏ
D. Xuất hiện hiện tượng gì
Lời giải chi tiết: Chọn B, hiện tượng thu được khi nhỏ từ từ NaOH vào dung dịch AlCl3 là kết tủa keo trắng, sao đó kết tủa tan.
AlCl3 + 3NaOH Al(OH)3 kết tủa + 3 NaCl. NaOH dư, kết tủa Al(OH)3 tan theo Phương trình hoá học:
NaOH + Al(OH)3 kết tủa + 2H2O
Câu 12: Dùng hoá chất nào sau đây để phân biệt Zn (NO3) và Al (NO3)
A. Dùng dung dịch NaOH
B. Dùng dung dịch Ba(OH)2
C. Dùng dung dịch NH3
D. Dùng dung dịch nước vôi trong
Hướng dẫn giải chi tiết: Chọn đáp án C
Khi cho NH3 vào 2 dung dịch cả 2 dung dịch đều xuất hiện kết tủa hidroxit, nhưng Zn(OH)2 tạo thành có khả năng tạo phức với NH3 nên kết tủa lại tan còn với Al(OH)3 không tan trong NH3.
Al(NO3) + 3nh3 + 3H2O → Al (OH)3 kết tủa + 3NH3NO3
Zn(NO3)2 + 2NH3 + 2H2O → Zn(OH)2 kết tủa + 2NH4NO3
Dung dịch amoniac có khả năng hoà tan hidroxit hay muối ít tan của một số kim loại (Ag, Cu, Zn) tạo thành các dung dịch phức chất.
Câu 13: Cho 200ml dung dịch AlCl2 1M tác dụng với dung dịch NaOH 0,5M thu được một kết tủa keo. Thể tích của dung dịch NaOH 0,5M lớn nhất cần dùng là bao nhiêu, biết kết tủa keo sau đi đem sấy khô thu được khối lượng là 7,8 gam.
a. 0,6 lít
B. 1,9 lít
C. 1,4 lit
D. 0,8 lít
Lời giải chi tiết: Chọn C
Ta có: n Al3+ = 0,2 mol; n kết tủa = 0,1 mol
Do n kết tủa < n Al3+ mà đề bài yêu cầu tính thể tích dung dịch NaOH lớn nhất có nghĩa là tính nOH- max nên nOH- = 4. 0,2 - 0,1 = 0,7 mol
Vậy thể tích dung dịch NaOH 0,5M lớn nhất cần dùng là 1,4 lít
Câu 14: Để phân biệt dung dịch AlCl3 và dung dịch KCl ta dùng dung dịch:
A. NaOH
B. HCl
C. NaNO3
D. H2SO4
Hướng dẫn giải chi tiết: Chọn A. Dùng dung dịch NaOH để phân biệt dung dịch AlCl3 và KCl
Trích mẫu thử của hai dung dịch ra hai ống nghiệm có đánh số. Nhỏ NaOH dư vào từng ống nghiệm, thấy:
- Xuất hiện kết tủa trắng sau đó kết tủa tạn AlCl3
AlCl3 + 3NaOH → Al(OH)3 kết tủa + 3NaCl
Al(OH)3 + NaOH → NaAlO2 + 2H2O
- Không thấy hiện tượng gì: KCl
Câu 15: Thu được 7,8 gam kết tủa khi cho dung dịch NaOH vào 200ml dung dịch AlCl3 1M. Hỏi nồng độ mol của dung dịch NaOH đã dùng là?
A/ 3M
B. 1,5 M hoặc 3,5M
C. 1,5 M
D. 1,4 M hoặc 3M
Lời giải chi tiết: Chọn B
Ta có: nAl3+ = 0,2 mol; n kết tủa bằng 0,1 mol do n kết tủa < nAl3+ nên có 2 khả năng:
+ nOH- min thì nOH- = 3 . n kết tủa = 0,3 mol vậy CM(NaOH) = 1,5 M
+ nOH- max thì n OH- = 4 . nAl3+ - n kết tủa = 0,7 mol vậy CM(NaOH) = 3,5M
Câu 16: Trộn dung dịch chứa a mol AlCl3 với dung dịch chứa b mol NaOH. Để thu được kết tủa thì cần có tỉ lệ là?
Lời giải chi tiết:
- Khi cho Al3+ phản ứng với ion OH- có thể xảy ra các phản ứng:
(1) Al3+ + 3OH- → Al(OH)3
(2) Nếu lượng OH- dư thì OH- hoà tan kết tủa Al(OH)3 + OH- → Al(OH)4-
Để sau phản ứng thu được kết tủa thì:
- chỉ xảy ra quá trình (1) tức là 3a lớn hơn hoặc bằng b hay a : b lớn hơn hoặc bằng 1/3 (*)
- Xảy ra đồng thời quá trình (1); (2) và lượng OH- dư < lượng kết tủa Al(OH)3- tạo thành a > b - 3a >b
=> Tỉ lệ a: b = 1: 4
Câu 17: Cho một mẫu Na vào 200ml dung dịch AlCl3 thu được 2,8 lít khí ở điều kiện tiêu chuẩn và kết tủa A. Nung A đến khối lượng không đổi thu được 2,55 gam chất rắn. Tính nồng độ mol/l của dung dịch AlCl3
Hướng dẫn giải chi tiết:
m rắn = Al2O3 => số mol của Al2O3 = 0,025 mol => số mol Al(OH)3 = 0,05 mol số mol NaOH = 2 số mol H2 = 0,25 mol
Trường hợp 1: NaOH thiếu, chỉ có phản ứng. 3NaOH + AlCl3 → Al(OH)3 + 3NaCl
Không xảy ra vì số mol Al(OH03 tạo ra trong phản ứng lớn hơn số mol Al(OH)3 đề cho
Trường hợp 2: NaOH dư, có 2 phản ứng xảy ra:
3NaOH + AlCl3 → Al(OH)3 + 3NaCl
0,15 0,05 0,05 (mol)
4NaOH + AlCl3 → NaAlO2 + 3NaCl + H2O (0,25 - 0,15) 0,025
Tổng số mol AlCl3 phản ứng ở 2 phương trình là 0,075 mol => Nồng độ của AlCl3 = 0,375M
Câu 18: Cho hỗn hợp Al2O3, Cu, Fe2O3 vào dung dịch H2SO4 loãng dư thu được dung dịch X và chất rắn Y. Cho từ từ NaOH tới dư vào dung dịch X thu được dung dịch Z và kết tủa M. Nung kết tủa M ngoài không khí cho đến khối lươn không đổi, thu được chất rắn N. Cho khí CO dư đi qua N nung nóng thu được chất rắn P.
A, Xác định thành phần các chất có trong X, Y, Z, M, N, P. Biết các phản ứng đều xảy ra hoàn toàn
B. Viết các phương trình hoá học xảy ra
Giải:
A. Cho hỗn hợp vào dung dịch H2SO4 loãng dư thu được dung dịch X gồm: Al2(SO4), FeSO4, CuSO4
- Chất rắn Y: Cu
- Cho từ từ NaOH tới du vào dung dịch X thì thu được dung dịch Z gồm: NaAlO2, Na2SO4:
+ kết tủa M: Fe(OH)2, Cu(OH)2
+ Nung kết tủa M ngoài không khí đến khối lượng không đổi thu được chất rắn N là: Fe2O3, CuO
+ Cho khí CO dư đi qua N nung nóng thu được chất rắn P là Fe, Cu
B, Phương trình hoá học
- Với dung dịch H2SO4:
Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O
Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2O
Cu + Fe2(SO4)3 → 2FeSO4 + CuSO4
- Với dung dịch NaOH:
CuSO4 + 2NaOH → Cu(OH)2 + Na2SO4
FeSO4 + 2NaOH → Fe(OH)2 + Na2SO4
Al2(SO4)3 + 6NaOH → 2Al(OH)3 + 3Na2SO4
Al(OH)3 + NaOH → NaAlO2 + 2H2O
- Nung kết tủa M:
- Khí CO khử:
Câu 19: Hỗn hợp X gồm các oxit BaO, CuO, Fe2O3, Al2O3 có cùng một số mol. Dẫn một luồng khí CO dư qua hỗn hợp X nung nóng đến khi phản ứng xảy ra hoàn toàn, thu được hỗn hợp khí A và hỗn hợp rắn B. Cho B vào nước dư thu được dung dịch C và hỗn hợp rắn D. Cho D tác dụng với H2SO4 đặc, nóng dư, thu được dung dịch E và khi SO2 duy nhất. Sục khí A vào dung dịch C được dung dịch G và kết tủa H. Xác định thành phần của A, B, C, D, E, G, H và các phương trình hoá học xảy ra.
Xem thêm các phương trình hóa học khác:
Al + HNO3 → Al(NO3)3 + N2 + H2O
Al + HNO3 → Al(NO3)3 + NH4NO3 + H2O
Xem thêm các chương trình khác:
- Các dạng bài tập Tiếng Anh thông dụng nhất
- 3000 câu hỏi ôn tập môn Tiếng Anh có đáp án
- Toàn bộ kiến thức về cụm động từ | Định nghĩa và cách dùng
- 500 đoạn văn Tiếng Anh thông dụng nhất và cách làm
- 1000 câu hỏi ôn tập môn Công nghệ có đáp án
- 1000 câu hỏi ôn tập Giáo dục công dân
- 15000 câu hỏi ôn tập môn Toán có đáp án
- Wiki Toán | Khái niệm, định lí, tính chất, dạng bài, công thức
- Tuyển tập đề thi + chuyên đề ôn thi Toán Kangaroo các cấp độ (có đáp án 2024)
- 3000 câu hỏi ôn tập môn Vật lí có đáp án
- Tổng hợp Dạng bài - Công thức môn Vật lí
- 2000 câu hỏi ôn tập môn Tin học có đáp án
- 3000 câu hỏi ôn tập môn Lịch sử có đáp án
- 3000 câu hỏi ôn tập môn Địa lí có đáp án
- 2000 câu hỏi ôn tập môn Sinh học có đáp án
- Tổng hợp Dạng bài - Công thức môn Sinh học
- Tổng hợp về các tác giả văn học
- 3000 câu hỏi ôn tập môn Ngữ văn có đáp án
- Tổng hợp kiến thức Ngữ Văn
- Tuyển tập truyện dân gian, truyền thuyết, cổ tích,... Việt Nam
- Tổng hợp các đề đọc - hiểu có đáp án chi tiết
- Trò chơi Powerpoint | Game Powerpoint
- Tổng hợp bài thu hoạch BDTX Giáo viên mầm non (2025) theo Thông tư 12
- Tổng hợp bài thu hoạch BDTX Giáo viên tiểu học (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THCS (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THPT (2025)
