K + H2O → KOH + H2 | K ra KOH
K + H2O → KOH + H2 là phản ứng thế. Bài viết này cung cấp đầy đủ thông tin về phương trình hóa học đã được cân bằng, điều kiện các chất tham gia phản ứng, hiện tượng (nếu có), ... Mời các bạn đón xem:
Phản ứng K + H2O → KOH + H2
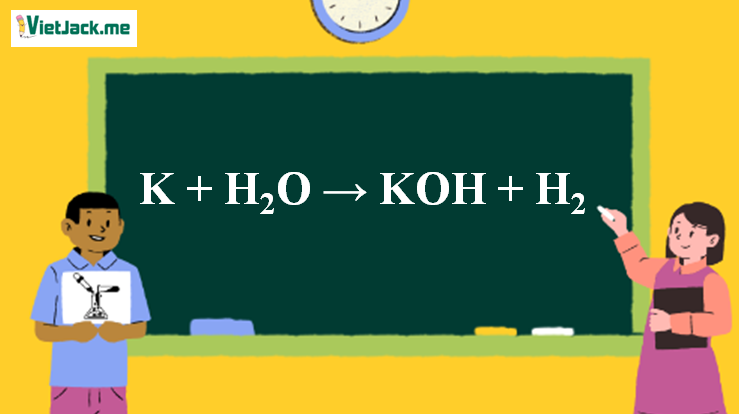
1. Phương trình hóa học K ra KOH
2K + 2H2O → 2KOH + H2
2. Điều kiện phản ứng giữa kim loại K với H2O
Nhiệt độ thường
3. Cách thực hiện phản ứng K với H2O
Cho mẩu nhỏ kali vào cốc nước.
4. Hiện tượng nhận biết phản ứng kim loại K với H2O
Kali (K) màu trắng bạc phản ứng mạnh với nước và xuất hiện bọt khi do Hidro (H2) được giải phóng, sau phản ứng thu được dung dịch kiềm, làm quỳ tím chuyển sang màu xanh.
5. Tính chất hóa học của Kali
K có tính khử rất mạnh.
5.1. Tác dụng với phi kim
Ví dụ:
4K + O2 → 2K2O
2K + Cl2 → 2KCl
Khi đốt trong không khí hay trong oxi, kali cháy tạo thành các oxit (oxit thường, peoxit và supeoxit) và cho ngọn lửa có màu tím hoa cà đặc trưng.
5.2. Tác dụng với axit
Kali dễ dàng khử ion H+ (hay H3O+) trong dung dịch axit loãng (HCl, H2SO4 loãng...) thành hidro tự do.
Ví dụ: 2K + 2HCl → 2KCl + H2.
5.3. Tác dụng với nước
K tác dụng mãnh liệt với nước và tự bùng cháy tạo thành dung dịch kiềm và giải phóng khí hidro.
2K + 2H2O → 2KOH + H2.
5.4. Tác dụng với hidro
Kali tác dụng với hidro ở áp suất khá lớn và nhiệt độ khoảng 350 – 400oC tạo thành kali hidrua.
2K (lỏng) + H2 (khí) → 2KH (rắn)
6. Tính chất hóa học của H2O
6.1. Nước tác dụng với kim loại
Ở điều kiện thường, nước có thể phản ứng với các kim loại mạnh như Li, Ca, Na, K, Ba,… để tạo thành dung dịch Bazo và khí Hidro.
H2O + Kim loại → Bazơ + H2↑
2M + 2nH2O → 2M(OH)n + nH2↑
2Na + 2H2O → 2NaOH + H2
2K + 2H2O → 2KOH + H2
Ca + 2H2O → Ca(OH)2 + H2
Ba + 2H2O → Ba(OH)2 + H2
Đặc biệt, một số kim loại trung bình như Mg, Zn, Al, Fe,…phản ứng được với hơi nước ở nhiệt độ cao tạo ra oxit kim loại và hidro. Bên cạnh đó, kim loại Mg tan rất chậm trong nước nóng.
6.2. Nước tác dụng với oxit bazo
Nước tác dụng với một số oxit bazo như Na2O, CaO , K2O,… tạo thành dung dịch bazo tương ứng. Dung dịch bazo làm cho quỳ tím hóa xanh.
H2O + Oxit bazơ → Bazơ
Na2O + H2O → 2NaOH
Li2O + H2O→ 2LiOH
K2O + H2O→ 2KOH
CaO + H2O → Ca(OH)2
6.3. Nước tác dụng với oxit axit
Nước tác dụng với oxit axit tạo thành axit tương ứng. Dung dịch axit làm quỳ tím hóa đỏ.
H2O + Oxit axit → Axit
CO2 + H2O → H2CO3
SO2 + H2O → H2SO3
P2O5 + 3H2O → 2H3PO4
SO3 + H2O → H2SO4
N2O5 + H2O → 2HNO3
7. Vai trò của H2O
- Nước rất cần thiết cho đời sống hàng ngày, sản xuất nông nghiệp, công nghiệp, xây dựng, giao thông vận tải... Sự sống trên Trái Đất đều bắt nguồn từ nước và phụ thuộc vào nước. Nước có ảnh hưởng quyết định đến khí hậu một khu vực và là nguyên nhân tạo ra thời tiết.
- Nước là thành phần quan trọng của các tế bào sinh học và là môi trường của các quá trình sinh hóa cơ bản như quang hợp tạo thành khí oxi:
6H2O + 6CO2 →(quang hợp) C6H12O6 + 6O2
- Nước tham gia và nhiều quá trình hoá học quan trọng trong cơ thể người và động vật. Nước chiếm hơn 70% cơ thể chúng ta.
8. Bài tập vận dụng
Câu 1. Nhỏ từ từ từng giọt đến hết 30 ml dung dịch HCl 1M vào 100 ml dung dịch chứa K2CO3 0,2M và KHCO3 0,2M. Sau khi phản ứng kết thúc, thể tích khí CO2 thu được là
A. 224 ml.
B. 336 ml.
C. 672 ml.
D. 448 ml.
Lời giải:
Đáp án: A
Giải thích:
nHCl= 0,03 (mol)
nK2CO3 = 0,1.0,2 = 0,02 (mol);
nKHCO3 = 0,1.0,2 = 0,02 (mol)
Khi nhỏ từ từ H+ vào dd hỗn hợp CO32- và HCO3- xảy ra phản ứng:
H+ + CO32- → HCO3- (1)
H+ + HCO3- → CO2 + H2O (2)
=> nCO2(2) = ∑nH+ - nCO32- = 0,03 – 0,02 = 0,01 (mol)
=> VCO2 (đktc) = 0,01.22,4 = 0,224 (l) = 224 (ml)
Câu 2. Dãy gồm các kim loại đều phản ứng với nước ở nhiệt độ thường tạo ra dung dịch có môi trường kiềm là
A. Na, Ba, K
B. Be, Na, Ca
C. Na, Fe, K
D. Na, Cr, K
Lời giải:
Đáp án: A
Giải thích:
2A + 2H2O → 2AOH + H2 (A là kim loại kiềm)
B + 2H2O → B(OH)2 + H2(B là kim loại kiềm thổ, trừ Be)
2Na + 2H2O → 2NaOH + H2
Ba + 2H2O → Ba(OH)2 + H2
2K + 2H2O → 2KOH + H2
Câu 3. Nhận định nào sau đây không đúng về kim loại kiềm?
A. Đều có cấu tạo mạng tinh thể giống nhau: lập phương tâm khối
B. Là những nguyên tố mà nguyên tử có 1 e ở phân lớp p
C. Dễ bị oxi hóa
D. Năng lượng ion hóa thứ nhất của các nguyên tử kim loại kiềm thấp hơn so với các nguyên tố khác trong cùng chu kì
Lời giải:
Đáp án: B
Câu 4. Nhận định nào sau đây là đúng:
A. Bari là nguyên tố có tính khử mạnh nhất trong dãy kim loại kiềm thổ
B. Tất cả các kim loại kiềm thổ đều tan trong nước ở nhiệt độ thường
C.Kim loại kiềm thổ có tính khử mạnh hơn kim loại kiềm
D. Tính khử của các kim loại kiềm thổ tăng dần từ Be đến Ba.
Lời giải:
Đáp án: D
Giải thích:
Mg và Be không phản ứng với nước ở điều kiện thường B sai.
Đi từ đầu nhóm IIA đến cuối nhóm theo chiều tăng dần điện tính hạt nhân tính kim loại (tính khử) tăng dần => Kim loại mạnh nhất là Ra; yếu nhất là Be. => A sai, D đúng.
Nhóm Kim loại kiềm có tính khử mạnh nhất => C sai.
Câu 5. Cặp chất nào dưới đây có phản ứng
A. H2SO4 và KHCO3.
B. MgCO3 và HCl.
C. Ba(OH)2 và K2CO3.
D. NaCl và K2CO3.
Lời giải:
Đáp án: D
Câu 6. Khi cho quỳ tím vào dung dịch axit, quỳ tím chuyển màu gì:
A. Đỏ
B. Xanh
C. Tím
D. Không màu
Lời giải:
Đáp án: A
Câu 7. Cho mẩu K vào nước thấy có 4,48 lít (đktc) khí bay lên. Tính khối lượng K
A. 9,2 g
B. 15,6 g
C. 7,8 g
D. 9,6 g
Lời giải:
Đáp án: B
Giải thích:
nH2 = 4,48/22,4 = 0,2 mol
2K + 2H2O → 2KOH + H2
0,4 ← 0,2 mol
mK = 0,4.39 = 15,6 gam
Câu 8. Cho quỳ tím vào nước vôi trong, hiện tượng xảy ra là
A. Quỳ tím chuyển màu đỏ
B. Quỳ tím không đổi màu
C. Quỳ tím chuyển màu xanh
D. Không có hiện tượng
Lời giải:
Đáp án: C
Xem thêm các phương trình phản ứng hóa học khác:
BaCl2 + NaHSO4 → BaSO4 + Na2SO4 + HCl
Xem thêm các chương trình khác:
- Các dạng bài tập Tiếng Anh thông dụng nhất
- 3000 câu hỏi ôn tập môn Tiếng Anh có đáp án
- Toàn bộ kiến thức về cụm động từ | Định nghĩa và cách dùng
- 500 đoạn văn Tiếng Anh thông dụng nhất và cách làm
- 1000 câu hỏi ôn tập môn Công nghệ có đáp án
- 1000 câu hỏi ôn tập Giáo dục công dân
- 15000 câu hỏi ôn tập môn Toán có đáp án
- Wiki Toán | Khái niệm, định lí, tính chất, dạng bài, công thức
- Tuyển tập đề thi + chuyên đề ôn thi Toán Kangaroo các cấp độ (có đáp án 2024)
- 3000 câu hỏi ôn tập môn Vật lí có đáp án
- Tổng hợp Dạng bài - Công thức môn Vật lí
- 2000 câu hỏi ôn tập môn Tin học có đáp án
- 3000 câu hỏi ôn tập môn Lịch sử có đáp án
- 3000 câu hỏi ôn tập môn Địa lí có đáp án
- 2000 câu hỏi ôn tập môn Sinh học có đáp án
- Tổng hợp Dạng bài - Công thức môn Sinh học
- Tổng hợp về các tác giả văn học
- 3000 câu hỏi ôn tập môn Ngữ văn có đáp án
- Tổng hợp kiến thức Ngữ Văn
- Trò chơi Powerpoint | Game Powerpoint
- Tổng hợp bài thu hoạch BDTX Giáo viên mầm non (2024) theo Thông tư 12
- Tổng hợp bài thu hoạch BDTX Giáo viên tiểu học (2024)
- Tổng hợp bài thu hoạch BDTX Giáo viên THCS (2024)
- Tổng hợp bài thu hoạch BDTX Giáo viên THPT (2024)
