AgNO3 + HCl ⟶ AgCl + HNO3 | AgNO3 ra AgCl | HCl ra HNO3
AgNO3 + HCl ⟶ AgCl + HNO3 là phản ứng trao đổi. Bài viết này cung cấp đầy đủ thông tin về phương trình hóa học đã được cân bằng, điều kiện các chất tham gia phản ứng, hiện tượng (nếu có), ... Mời các bạn đón xem:
Phản ứng: AgNO3 + HCl ⟶ AgCl + HNO3
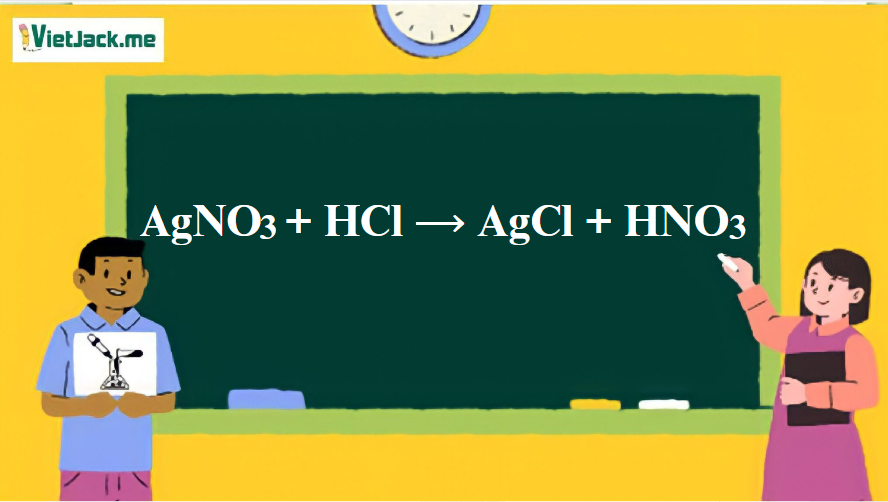
1. Phương trình phản ứng hóa học giữa AgNO3 và HCl
AgNO3 + HCl ⟶ AgCl + HNO3
2. Điều kiện xảy ra phản ứng
Không có
3. Cách thức thực hiện phản ứng
Cho AgNO3 tác dụng với dd axit HCl.
4.Hiện tượng nhận biết
Xuất hiện kết tủa trắng bạc clorua (AgCl)
5. Bản chất của các chất tham gia phản ứng
5.1 Bản chất của AgNO3
AgNO3 (nitrat bạc) là chất oxi hóa và tác nhân oxi hóa, mang đầy đủ tính chất hóa học của muối.
5.2 Bản chất của HCl
Dung dịch axit HCl có đầy đủ tính chất hoá học của một axit mạnh.
6. Tính chất hóa học của AgNO3
- Mang tính chất hóa học của muối
6.1Tác dụng với muối
AgNO3 + NaCl →AgCl↓+ NaNO3
2AgNO3 + BaCl2 →2AgCl↓+ Ba(NO3)2
6.2 Tác dụng với kim loại:
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag
6.3 Tác dụng với axit:
AgNO3 + HI → AgI ↓ + HNO3
6.4 Oxi hóa được muối sắt (II)
Fe(NO3)2 + AgNO3 → Fe(NO3)3 + Ag
7. Tính chất hóa học của HCl
Dung dịch axit HCl có đầy đủ tính chất hoá học của một axit mạnh.
7.1 Tác dụng chất chỉ thị:
Dung dịch HCl làm quì tím hoá đỏ (nhận biết axit)
HCl → H+ + Cl-
7.2 Tác dụng với kim loại
Tác dụng với KL (đứng trước H trong dãy Bêkêtôp) tạo muối (với hóa trị thấp của kim loại) và giải phóng khí hidrô (thể hiện tính oxi hóa)
Fe + 2HCl 
2Al + 6HCl 
Cu + HCl → không có phản ứng
7.3 Tác dụng với oxit bazo và bazo:
Sản phẩm tạo muối và nước
NaOH + HCl → NaCl + H2 O
CuO + 2HCl 
Fe2 O3 + 6HCl
7.4 Tác dụng với muối (theo điều kiện phản ứng trao đổi)
CaCO3 + 2HCl → CaCl2 + H2O + CO2↑
AgNO3 + HCl → AgCl↓ + HNO3
(dùng để nhận biết gốc clorua )
Ngoài tính chất đặc trưng là axit , dung dịch axit HCl đặc còn thể hiện vai trò chất khử khi tác dụng chất oxi hoá mạnh như KMnO4, MnO2, K2 Cr2O7, MnO2, KClO3 ……
4HCl + MnO2 
K2 Cr2 O7 + 14HCl → 3Cl2 + 2KCl + 2CrCl3 + 7H2 O
Hỗn hợp 3 thể tích HCl và 1 thể tích HNO3 đặc được gọi là hỗn hợp nước cường toan ( cường thuỷ) có khả năng hoà tan được Au ( vàng)
3HCl + HNO3 → 2Cl + NOCl + 2H2O
NOCl → NO + Cl
Au + 3Cl → AuCl3
8. Ứng dụng của AgNO3
AgNO3 được sử dụng để tạo ra chất kết dính dẫn điện, máy lọc khí mới, quần áo cân bằng áp suất mạ bạc hay gang tay để làm việc trực tiếp. Nó cũng là vật liệu nhạy sáng cho phim, phim x-quang và phim ảnh. Được sử dụng để mạ bạc các linh kiện điện tử và thủ công mỹ nghệ khác…
9. Bài tập vận dụng liên quan
Câu 1. Nhận xét nào dưới đây không đúng khi nhắc về muối nitrat
A. Tất cả các muối nitrat đều dễ tan trong nước
B. Muối nitrat rất kém bền nhiệt, dễ bị phân hủy
C. Khi nhiệt phân muối nitrat rắn ta đều thu được khí NO2
D. Muối nitrat là chất điện li mạnh, khi tan trong nước phân li ra cation kim loại và anion nitrat
Lời giải:
Đáp án C
Nhận xét không đúng khi nhắc về muối nitrat: Khi nhiệt phân muối nitrat rắn ta đều thu được khí NO2
Sai vì muối nitrat của K, Na, Ba, Ca nhiệt phân không thu được khí NO2
Câu 2. Khi bị nhiệt phân, dãy muối nitrat nào sau đây đều cho sản phẩm là kim loại, khí nitơ đioxit và khí oxi?
A. Zn(NO3)2, KNO3, Pb(NO3)2
B. Cu(NO3)2, LiNO3, KNO3
C. Ca(NO3)2, LiNO3, KNO3
D. Hg(NO3)2, AgNO3
Lời giải:
Đáp án D
Nhiệt phân cho sản phẩm kim loại, khí nitơ đioxit và khí oxi là kim loại nhóm III.
Phương trình phản ứng nhiệt phân xảy ra là:
Hg(NO3)2 Hg + 2NO2↑ + O2↑
2AgNO3 2Ag + 2NO2 ↑+ O2↑
=> dãy muối cho sản phẩm kim loại, khí nitơ đioxit và khí oxi là: Hg(NO3)2, AgNO3
Câu 3. Cho các nội dung nhận định sau:
1) Muối nitrat là chất điện li mạnh, khi tan trong nước phân li ra cation kim loại và anion nitrat
2) Ion NO3- có tính oxi hóa trong môi trường axit.
3) Khi nhiệt phân muối nitrat rắn ta đều thu được khí NO2.
4) Hầu hết muối nitrat đều bền nhiệt.
Nhận định nào đúng trong các nhận định trên
A. (1), (2), (3).
B. (2) và (4).
C. (2) và (3).
D. (1) và (2).
Lời giải:
Đáp án D
Các mệnh đề đúng là: (1) và (2)
(3) sai vì muối nitrat của K, Na, Ba, Ca nhiệt phân không thu được khí NO2
(4) sai vì các muối nitrat hầu hết kém bền nhiệt
Câu 4. Khi nhiệt phân, dãy muối nitrat nào đều cho sản phẩm là oxit kim loại, khí nitơ đioxit và khí oxi
A. Cu(NO3)2, Fe(NO3)2, Mg(NO3)2
B. Cu(NO3)2, MgNO3, Pb(NO3)2
C. Hg(NO3)2, AgNO3, Ca(NO3)2
D. Zn(NO3)2, AgNO3, Pb(NO3)2
Lời giải:
Đáp án B
Khi nhiệt phân, dãy muối nitrat cho sản phẩm là oxit kim loại, khí nitơ đioxit và khí oxi là:
2Cu(NO3)2 → 2CuO + 4NO2 + O2↑
2Mg(NO3)2 → 2MgO + 4NO2 ↑ + O2 ↑
2Pb(NO3)2 → 2PbO + 4NO2 + O2
Câu 5. Phân biệt 5 dung dịch riêng biệt sau: NH4NO3; (NH4)2SO4; NaCl; Mg(NO3)2 và FeCl2 bằng
A. BaCl2
B. NaOH
C. Ba(OH)2
D. AgNO3
Lời giải:
Đáp án C. Ba(OH)2
|
|
NH4NO3 |
(NH4)2SO4 |
NaCl |
Mg(NO3)2 |
FeCl2 |
|
Ba(OH)2 |
↑ mùi khai |
↑ mùi khai và ↓ trắng |
Không ht |
↓ trắng |
↓ trắng xanh |
Phương trình phản ứng:
2NH4NO3 + Ba(OH)2 → Ba(NO3)2 + 2NH3↑ + 2H2O
(NH 4)2SO4 + Ba(OH) 2 → BaSO4 + 2NH3 + 2H2O
Ba(OH)2 + Mg(NO3)2 → Ba(NO3)2 + Mg(OH)2
Ba(OH)2 + FeCl2 → BaCl2 + Fe(OH)2
Câu 6. Nung nóng 33,1 gam Pb(NO3)2 thu được 27,7 gam chất rắn. Tính hiệu suất của phản ứng phân hủy.
A. 50%
B. 30%
D. 70%
C. 60%
Lời giải:
Đáp án A
Phương trình phản ứng:
Pb(NO3)2 → PbO + 2NO2 + 1/2 O2
x 2x 1/2x mol
mNO2+ mO2= 46.2x + 32.0,5x = 33,1 – 27,7 ⇒ x = 0,05 mol
a) Khối lượng của Pb(NO3)2 phản ứng là: mPb(NO3)2= 0,05.331 = 16,55 gam
Hiệu suất phản ứng thủy phân là: H = 16,55/33,1.100% = 50%
Câu 7. Khi nhiệt phân hoàn toàn muối nitrat của kim loại hóa trị 1 thu được 16,2 gam kim loại và 5,04 lít khí (đktc). Xác định công thức và tính khối lượng muối ban đầu.
A. 24,10
B. 12,05
C. 48,20
D. 32,10
Lời giải:
Đáp án B
Gọi kim loại cần tìm là M ⇒ muối nitrat là: MNO3
MNO3 → M + NO2 + 1/2 O2
x → x → x → x/2
x + x/2 = 1,5x = 5,04 /22,4 = 0,225 ⇒ x = 0,15
M = 16,2 /0,15 = 108 ⇒ M là Ag
mchất rắn = 33,65 – (0,4.46 + 0,1.32) = 12,05 gam
Câu 8. Muối nào sau đây không bị nhiệt phân hủy?
A. CaCO3.
B. Na2CO3.
C. KNO3.
D. KCIO3.
Lời giải:
Đáp án B
Muối Na2CO3 không bị nhiệt phân hủy.
Các muối còn lại bị nhiệt phân hủy:
CaCO3→ CaO + CO2
2KNO3 → 2KNO2 + O2
2KClO3 → 2KCl + 3O2
Câu 9. Khi nhiệt phân hỗn hợp chất rắn sau: (NH4)2CO3, KHCO3, Mg(HCO3)2, FeCO3 đến khối lượng không đổi trong môi trường không có không khí thì sản phẩm rắn gồm các chất:
A. FeO, MgO, K2CO3
B. FeO, MgCO3, K2CO3
C. Fe2O3, MgO, K2O
D. Fe2O3, MgO, K2CO3
Lời giải:
Đáp án A
Nhiệt phân đến khối lượng không đổi:
(NH4)2CO3 → 2NH3 + CO2 + H2O
2KHCO3 → K2CO3 + H2O + CO2
Mg(HCO3)2 → MgO + CO2 + H2O
FeCO3 → FeO + CO2
Như vậy chất rắn sau phản ứng gồm: FeO, MgO, K2CO3
Câu 10. Cho các câu nhận xét sau, câu nhận xét không đúng là:
A. Than cốc được dùng trong quá trình luyện kim
B. Than muội làm chất độn cao su, sản xuất mực in và si đánh giầy
C. Than gỗ và than xương có cấu tạo xốp nên có khả năng hấp phụ mạnh, được dùng làm mặt nạ phòng chống độc và công nghiệp hoá chất
D. CO2 là chất khí dùng để chữa cháy, nhất là các đám cháy kim loại.
Lời giải:
Đáp án D
Câu không đúng là: CO2 là chất khí dùng để chữa cháy, nhất là các đám cháy kim loại.
Không dùng CO2 để dập tắt các đám cháy kim loại Mg, Al vì
CO2 + 2Mg C + 2MgO
Câu 11. Khi nhiệt phân, dãy muối nitrat nào đều cho sản phẩm là oxit kim loại, khí nitơ đioxit và khí oxi?
A. Cu(NO3)2, Fe(NO3)2, Zn(NO3)2
B. Cu(NO3)2, KNO3, Pb(NO3)2
C. Pb(NO3)2, AgNO3, Ba(NO3)2
D. Zn(NO3)2, AgNO3, Pb(NO3)2
Lời giải:
Đáp án A
Câu 12. Có thể phân biệt muối amoni với các muối khác bằng cách cho nó tác dụng với dung dịch kiềm, vì khi đó:
A. Thoát ra một chất khí màu lục nhạt
B. Thoát ra một chất khí không màu, mùi khai, làm xanh giấy quỳ tím ẩm
C. Thoát ra một chất khí màu nâu đỏ, làm xanh giấy quỳ tím ẩm
D. Thoát ra chất khí không màu, không mùi
Lời giải:
Đáp án B
Ta có: NH4+ + OH- → NH3 ↑ +H2O
=> Để phân biệt muối amoni với các muối khác là người ta cho muối amoni với dung dịch kiềm vì khi đó thoát ra một chất khí không màu, mùi khai, làm xanh giấy quỳ tím ẩm.
Xem thêm các chương trình khác:
- Các dạng bài tập Tiếng Anh thông dụng nhất
- 3000 câu hỏi ôn tập môn Tiếng Anh có đáp án
- Toàn bộ kiến thức về cụm động từ | Định nghĩa và cách dùng
- 500 đoạn văn Tiếng Anh thông dụng nhất và cách làm
- 1000 câu hỏi ôn tập môn Công nghệ có đáp án
- 1000 câu hỏi ôn tập Giáo dục công dân
- 15000 câu hỏi ôn tập môn Toán có đáp án
- Wiki Toán | Khái niệm, định lí, tính chất, dạng bài, công thức
- Tuyển tập đề thi + chuyên đề ôn thi Toán Kangaroo các cấp độ (có đáp án 2024)
- 3000 câu hỏi ôn tập môn Vật lí có đáp án
- Tổng hợp Dạng bài - Công thức môn Vật lí
- 2000 câu hỏi ôn tập môn Tin học có đáp án
- 3000 câu hỏi ôn tập môn Lịch sử có đáp án
- 3000 câu hỏi ôn tập môn Địa lí có đáp án
- 2000 câu hỏi ôn tập môn Sinh học có đáp án
- Tổng hợp Dạng bài - Công thức môn Sinh học
- Tổng hợp về các tác giả văn học
- 3000 câu hỏi ôn tập môn Ngữ văn có đáp án
- Tổng hợp kiến thức Ngữ Văn
- Tuyển tập truyện dân gian, truyền thuyết, cổ tích,... Việt Nam
- Trò chơi Powerpoint | Game Powerpoint
- Tổng hợp bài thu hoạch BDTX Giáo viên mầm non (2025) theo Thông tư 12
- Tổng hợp bài thu hoạch BDTX Giáo viên tiểu học (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THCS (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THPT (2025)
