Ag + H2SO4 → Ag2SO4 + SO2 + H2O | Ag ra Ag2SO4
Ag + H2SO4 → Ag2SO4 + SO2 + H2O là phản ứng oxi hóa khử. Bài viết này cung cấp đầy đủ thông tin về phương trình hóa học đã được cân bằng, điều kiện các chất tham gia phản ứng, hiện tượng (nếu có), ... Mời các bạn đón xem:
Phản ứng Ag + H2SO4 → Ag2SO4 + SO2 + H2O
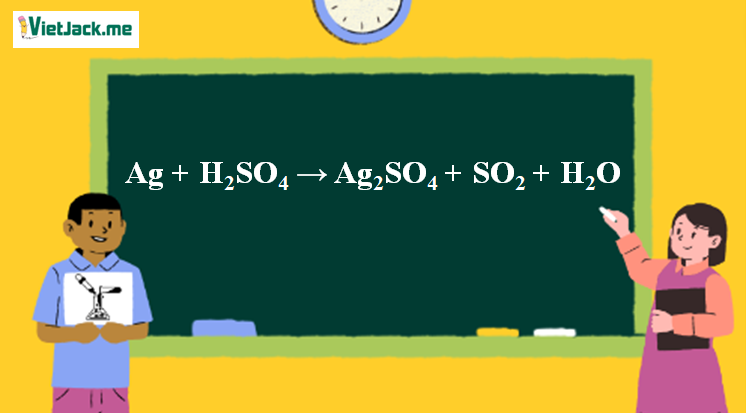
1. Phương trình phản ứng Ag tác dụng H2SO4 đặc
2Ag + 2H2SO4→ Ag2SO4 + SO2 + 2H2O
2. Điều kiện phản ứng xảy ra Ag tác dụng H2SO4 đặc
Nhiệt độ thường
3. Hiện tượng sau phản ứng
Bạc tan dần, xuất hiện khí không màu, có mùi hắc chính là lưu huỳnh đioxit (SO2).
4. Bản chất của các chất tham gia phản ứng
4.1. Bản chất của Ag (Bạc)
- Trong phản ứng trên Ag là chất khử.
- Ag không tác dụng với HCl và H2SO4 loãng, nhưng tác dụng với các axit có tính oxi hóa mạnh, như HNO3 hoặc H2SO4 đặc, nóng.
4.2. Bản chất của H2SO4 (Axit sunfuric)
- Trong phản ứng trên H2SO4 là chất oxi hoá.
- Trong H2SO4 thì S có mức oxi hoá +6 cao nhất nên H2SO4 đặc có tính axit mạnh, oxi hoá mạnh và háo nước.
5. Tính chất hóa học của H2SO4 đặc
Trong H2SO4 thì S có mức oxi hóa +6 cao nhất nên H2SO4 đặc có tính axit mạnh, oxi hóa mạnh và có tính háo nước.
Có những tính chất hóa học riêng
5.1. Axit sunfuric đặc tác dụng với kim loại trừ (Au, Pt)
Axit sunfuric tác dụng với kim loại tạo muối và nhiều sản phẩm oxi hóa khác nhau như SO2, H2S, S.
Ví dụ:
Cu + H2SO4 → CuSO4 + SO2 + H2O
Fe + H2SO4 → Fe2(SO4)3 + SO2 + H2O
Fe, Al, Cr bị thụ động hóa trong dung dịch HNO3 đặc, nguội
5.2. Tính háo nước của axit sunfuric đặc
C12H22O11 11H2O + 12C
5.3. Axit sunfuric đặc tác dụng với phi kim
C + 2H2SO4 đặc nóng → CO2 + 2SO2 + 2H2O
S + 2H2SO4 đặc nóng → 3SO2 + 2H2O
5.4. Axit sunfuric đặc tác dụng với các chất khử khác
H2SO4 đặc nóng + 8HI → H2S + 4I2 + 4H2O
6. Tính chất hoá học của Ag
Bạc kém hoạt động
Ag → Ag+ + 1e
6.1. Tác dụng với phi kim
- Bạc không bị oxi hóa trong không khí dù ở nhiệt độ cao.
- Tác dụng với ozon
2Ag + O3 → Ag2O + O2
6.2. Tác dụng với axit
Bạc không tác dụng với HCl và H2SO4 loãng, nhưng tác dụng với các axit có tính oxi hóa mạnh, như HNO3hoặc H2SO4 đặc, nóng.
3Ag + 4HNO3 (loãng) → 3AgNO3 + NO + 2H2O
2Ag + 2H2SO4 (đặc, nóng) → Ag2SO4 + SO2 + 2H2O
6.3. Tác dụng với các chất khác
- Bạc có màu đen khi tiếp xúc với không khí hoặc nước có mặt hidro sunfua:
4Ag + 2H2S + O2 (kk) → 2Ag2S + 2H2O
- Bạc tác dụng được với axit HF khi có mặt của oxi già:
2Ag + 2HF (đặc) + H2O2 → 2AgF + 2H2O
2Ag + 4KCN (đặc) + H2O2 → 2K[Ag(CN)2] + 2KOH
6.4. Ứng dụng của Ag
Ứng dụng cơ bản nhất của bạc là như một kim loại quý và các muối halôgen. Đặc biệt bạc nitrat được sử dụng rộng rãi trong phim ảnh (đây là ứng dụng nhiều nhất của bạc). Các ứng dụng khác còn có:
Các sản phẩm điện và điện tử, trong đó cần có tính dẫn điện cao của bạc, thậm chí ngay cả khi bị xỉn. Ví dụ, các bảng mạch in được làm từ sơn bạc, bàn phím máy tính sử dụng các tiếp điểm bằng bạc. Bạc cũng được sử dụng trong các tiếp điểm điện cao áp vì nó là kim loại duy nhất không đánh hồ quang ngang qua các tiếp điểm, vì thế nó rất an toàn.
Các loại gương cần tính phản xạ cao của bạc đối với ánh sáng được làm từ bạc như là vật liệu phản xạ ánh sáng. Các loại gương phổ biến có mặt sau được mạ nhôm.
Bạc được sử dụng để đúc tiền từ năm 700 TCN bởi người Lydia, trong dạng hợp kim của vàng và bạc. Muộn hơn, bạc được làm tinh khiết và đúc tiền trong dạng nguyên chất. Các từ "bạc" và "tiền" là có cùng ý nghĩa trong ít nhất 14 ngôn ngữ.
7. Bài tập vận dụng liên quan
Câu 1. Trong các trường hợp sau, trường hợp nào có thể hoà tan hoàn toàn chất rắn?
A. Cho hỗn hợp Ag, Ag2O vào dung dịch H2SO4 loãng.
B. Cho hỗn hợp Cu, Fe, Sn vào dung dịch FeCl3.
C. Cho hỗn hợp Al, Fe vào dung dịch HNO3 đặc nguội.
D. Cho hỗn hợp Na, Mg vào H2O.
Lời giải:
Cho Sn vào dung dịch FeCl3
Sn + 2Fe3+ → Sn2+ + 2Fe2+
Cu vào dung dịch FeCl3
2 FeCl3 + Cu → 2FeCl2 + CuCl2
Fe vào dung dịch FeCl3
Fe + 2FeCl3 → 3FeCl2
Câu 2. Cho hỗn hợp bột 2 kim loại Fe và Cu vào dung dịch AgNO3 sau phản ứng thu được hỗn hợp rắn gồm 2 kim loại. Dung dịch sau phản ứng gồm các chất
A. Fe(NO3)3 và AgNO3
B. Fe(NO3)3 và Cu(NO3)2
C. AgNO3 và Cu(NO3)2
D. Fe(NO3)2 và Cu(NO3)2
Lời giải:
Phương trình phản ứng :
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
Chất rắn Y gồm 2 kim loại là Cu và Ag; dung dịch X gồm Cu(NO3)2 và Fe(NO3)2
Câu 3. Những dung dịch nào sau đây không hoà tan được Cu?
A. Dung dịch muối Fe3+
B. Dung dịch HNO3 loãng
C. Dung dịch muối Fe2+
D. Dung dịch hỗn hợp HCl và NaNO3
Dung dịch Fe2+ không hòa tan được Cu kim loại.
Phương trình hóa học xảy ra
Cu + 2Fe(NO3)3 → 2Fe(NO3)2+ Cu(NO3)2
3Cu + 8NaNO3 + 8HCl → 3Cu(NO3)2 + 2NO + 8NaCl + 4H2O
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
Câu 4. Cho a gam Ag tác dụng hoàn toàn với dung dịch H2SO4 đặc dư thu được 4,48 lit khí SO2 (đktc). Giá trị a là
A. 47,2 gam
B. 43,2 gam
C. 46,8 gam
D. 46,6 gam
Lời giải:
Phương trình hóa học
2Ag + 2H2SO4 → Ag2SO4 + SO2 + 2H2O
nSO2 = 0,2 mol
Theo phương trình phản ứng ta có
nAg = 2.nSO2 = 0,1 mol => mAg = 0,4.108 = 43,2 gam
Câu 6. Một thanh kim loại M hóa trị 2 được nhúng vào trong 1 lít dung dịch CuSO4 0,5M. Sau khi lấy thanh M ra và cân lại ,thấy khối lượng thanh tăng 8 gam, nồng độ CuSO4 còn 0,3M. Hãy xác định kim loại M?
A. Fe
B. Mg
C. Zn
D. Pb
Lời giải:
M + Cu2+ → M2+ + Cu
Số mol Cu2+ phản ứng là: 1.(0,5 – 0,3) = 0,2 mol
Độ tăng khối lượng của thanh kim loaị M:
M = mCu – mM tan = 0,2.(64 – M) = 8
Suy ra: M = 24 là Zn
Câu 7. Cho m gam hỗn hợp bột các kim loại Ni và Cu vào dung dịch AgNO3 dư. Khuấy kĩ cho đến khi phản ứng kết thúc thu được 54 gam kim loại. Mặt khác cũng cho m gam hỗn hợp bột các kim loại trên vào dung dịch CuSO4 dư, khuấy kĩ cho đến khi phản ứng kết thúc, thu được kim loại có khối lượng bằng (m + 0,5) gam. Giá trị của m là:
A. 15,5
B. 16
C. 12,5
D. 18,5
Lời giải:
Gọi nNi= a mol; nCu = b mol có trong m gam hỗn hợp
Các phản ứng có thể xảy ra:
Ni + 2Ag+ → Ni2+ + 2Ag (1)
Cu + 2Ag+ → Cu2+ + 2Ag (2)
Ni + Cu2+ → Ni2+ + Cu (3)
- Từ (3) → ∆m↑ = (64 – 59).a = 0,5
→ x = 0,1 mol (*) - Từ (1) → nAg(1) = 0,2 mol
→ mAg(1) = 21,6 gam
→ mAg(2) = 54 – 21,6 = 32,4 gam → nAg(2) = 0,3 mol
→ y = 0,15 mol (**) - Từ (*) ; (**) → m = 0,1.59 + 0,15.64 = 15,5 gam
Câu 8. Có 6 dung dịch riêng biệt sau: NaCl, NaBr, KI, HCl, H2SO4, KOH. Để phân biệt các dung dịch trên, ta có thể dùng lần lượt các hợp chất nào sau đây?
A. quì tím, khí clo, dung dịch HNO3
B. dung dịch AgNO3, khí clo, hồ tinh bột
C. quì tím, AgNO3, dung dịch BaCl2
D. phenolphtalein, dung dịch Pb(NO3)2
Lời giải:
Câu 9. Trong dung dịch muối NaCl có lẫn NaBr và NaI. Để loại hai muối này ra khỏi dung dịch NaCl nên tiến hành theo cách nào dưới đây?
A. cô cạn hỗn hợp rồi sục khí Cl2 đến dư vào
B. cho hỗn hợp tác dụng với dung dịch HCl đặc.
C. cho hỗn hợp tác dụng với Cl2 sau đó đun nóng.
D. cho hỗn hợp tác dụng với AgNO3 sau đó đun nóng
Lời giải:
Để loại 2 muối này ra khỏi NaCl, người ta cho dung dịch hỗn hợp tác dụng với khí Cl2 dư, sau đó cô cạn dung dịch.
2NaBr + Cl2 → 2NaCl + Br2
2NaI + Cl2 → 2NaCl + I2
Câu 10. Nhận xét nào sau đây không đúng về H2SO4?
A. H2SO4 tan tốt trong nước
B. Ở điều kiện thường H2SO4 là chất rắn.
C. H2SO4 có tính axit mạnh.
D. H2SO4 đặc có tính háo nước.
Lời giải:
Câu 11. Kết luận nào không đúng khi nói về H2SO4:
A. H2SO4 loãng có đầy đủ tính chất chung của axit.
B. Khi tiếp xúc với H2SO4 đặc dễ gây bỏng nặng.
C. Khi pha loãng axit sunfuric, chỉ được cho từ từ nước vào axit
D. H2SO4 đặc là chất hút nước mạnh
Lời giải:
Câu 12. Dãy các chất không tác dụng được với dung dịch H2SO4 loãng là:
A. Zn, ZnO, Zn(OH)2.
B. Cu, CuO, Cu(OH)2.
C. Na2O, NaOH, Na2CO3.
D. MgO, MgCO3, Mg(OH)2.
Lời giải:
Oxit bazo, bazo và một số muối tác dụng được với dung dịch H2SO4 loãng
=> Đáp án: B vì có Cu đứng sau H2 không tác dụng được với H2SO4
Xem thêm các phương trình hóa học khác:
Xem thêm các chương trình khác:
- Các dạng bài tập Tiếng Anh thông dụng nhất
- 3000 câu hỏi ôn tập môn Tiếng Anh có đáp án
- Toàn bộ kiến thức về cụm động từ | Định nghĩa và cách dùng
- 500 đoạn văn Tiếng Anh thông dụng nhất và cách làm
- 1000 câu hỏi ôn tập môn Công nghệ có đáp án
- 1000 câu hỏi ôn tập Giáo dục công dân
- 15000 câu hỏi ôn tập môn Toán có đáp án
- Wiki Toán | Khái niệm, định lí, tính chất, dạng bài, công thức
- Tuyển tập đề thi + chuyên đề ôn thi Toán Kangaroo các cấp độ (có đáp án 2024)
- 3000 câu hỏi ôn tập môn Vật lí có đáp án
- Tổng hợp Dạng bài - Công thức môn Vật lí
- 2000 câu hỏi ôn tập môn Tin học có đáp án
- 3000 câu hỏi ôn tập môn Lịch sử có đáp án
- 3000 câu hỏi ôn tập môn Địa lí có đáp án
- 2000 câu hỏi ôn tập môn Sinh học có đáp án
- Tổng hợp Dạng bài - Công thức môn Sinh học
- Tổng hợp về các tác giả văn học
- 3000 câu hỏi ôn tập môn Ngữ văn có đáp án
- Tổng hợp kiến thức Ngữ Văn
- Trò chơi Powerpoint | Game Powerpoint
- Tổng hợp bài thu hoạch BDTX Giáo viên mầm non (2024) theo Thông tư 12
- Tổng hợp bài thu hoạch BDTX Giáo viên tiểu học (2024)
- Tổng hợp bài thu hoạch BDTX Giáo viên THCS (2024)
- Tổng hợp bài thu hoạch BDTX Giáo viên THPT (2024)
