NH3 + H2SO4 → (NH4)2SO4
NH3 + H2SO4 → (NH4)2SO4 là phản ứng hoá hợp. Bài viết này cung cấp đầy đủ thông tin về phương trình hóa học đã được cân bằng, điều kiện các chất tham gia phản ứng, hiện tượng (nếu có), ... Mời các bạn đón xem:
Phản ứng NH3 + H2SO4 → (NH4)2SO4
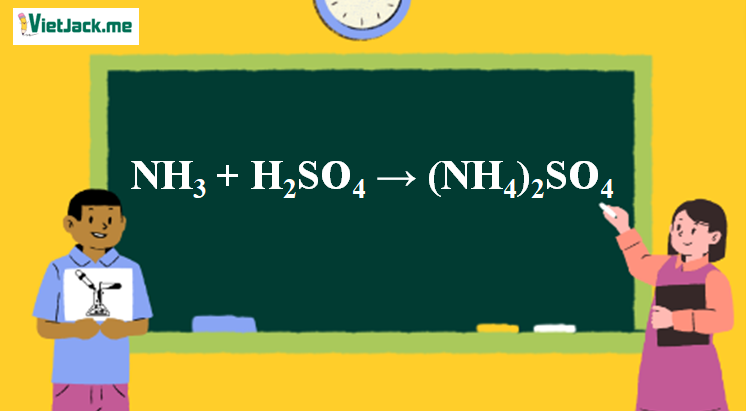
1. Phương trình phản ứng NH3 và H2SO4
2NH3 + H2SO4 → (NH4)2SO4
2. Điều kiện phản ứng xảy ra
Nhiệt độ thường.
3. Bản chất của NH3 (Amoniac) trong phản ứng
NH3 mang dầy đủ tính chất hoá học của một bazo yếu tác dụng với axit tạo thành muối amoni.
4. Tính chất hóa học của NH3
Amoniac có tính bazơ yếu
Amoniac do tính bazơ nên dung dịch amoniac làm cho quỳ tím hóa xanh còn dung dịch phenolphlatein từ màu chuyển thành hồng.
Do đó để phát hiện amoniac, người ta dùng quỳ tím ẩm để nhận biết.
Nguyên nhân: do cặp e chưa tham gia liên kết ở nguyên tử N
Ba(OH)2 > NaOH > NH3 > Mg(OH)2 > Al(OH)3
a) Amoniac phản ứng với nước
NH3 + H2O ⇔ NH4+ + OH-
b) Amoniac phản ứng với Axit → Muối Amoni
Thí dụ:
NH3 (khí) + HCl (khí) → NH4Cl (khói trắng)
NH3 + H2SO4 → NH4HSO4
2NH3 + H2SO4 → (NH4)2SO4
c) Amoniac tác dụng với dung dịch muối của các kim loại mà hidroxit không tan → bazơ và muối
NH3 + Muối (dung dịch) → Bazơ + Muối mới
Thí dụ
2NH3+ MgCl2 + 2H2O → Mg(OH)2 + 2NH4Cl
3NH3 + AlCl3+ 3H2O →Al(OH)3↓ + 3NH4Cl
* Chú ý: Với muối của Cu2+, Ag+ và Zn2+ có kết tủa sau đó kết tủa tan do tạo phức chất tan
Cu(NH3)4(OH)2; Ag(NH3)2OH; Zn(NH3)4(OH)2.
Thí dụ:
ZnSO4+ 2NH3+ 2H2O → Zn(OH)2↓ + (NH4)2SO4
Zn(OH)2 + 4NH3 → [Zn(NH3)3](OH)2
Amoniac có tính khử mạnh
Nguyên nhân: do N trong NH3 có mức oxi hóa thấp nhất -3
a) Amoniac tác dụng với O2
4NH3 + 3O2 2N2↑ + 6H2O
4NH3 + 5O2 4NO↑ + 6H2O
b) Amoniac tác dụng với Cl2
2NH3 + 3Cl2 N2↑ + 6HCl
8NH3 + 3Cl2 → N2↑ + 6NH4Cl
c) Amoniac tác dụng với oxit của kim loại
Thí dụ:
3CuO + 2NH3 Cu + 3H2O + N2↑
Khả năng tạo phức
Dung dịch amoniac có khả năng hòa tan hiđroxit hay muối ít tan của một số kim loại, tạo thành các dung dịch phức chất.
Ví dụ:
* Với Cu(OH)2:
Cu(OH)2 + 4NH3 → [Cu(NH3)4](OH)2 (màu xanh thẫm)
* Với AgCl:
AgCl + 2NH3 → [Ag(NH3)2]Cl
Sự tạo thành các ion phức là do sự kết hợp các phân tử NH3 bằng các electron chưa sử dụng của nguyên tử nitơ với ion kim loại.
5. Tính chất vật lý của NH3
Amoniac là một chất khí không màu. Amoniac hóa lỏng nhìn giống nước, không màu, có mùi hôi hăng nồng đặc trưng. NH3 là chất dễ hóa lỏng bởi amoniac có độ phân cực lớn do NH3 có cặp electron tự do và liên kết N-H bị phân cực. Nó nhẹ hơn không khí, mật độ của amoniac gấp 0,589 lần không khí.
Dung dịch Amoniac là dung môi hòa tan tốt.
Tại áp suất tiêu chuẩn 1 atm, khối lượng của một phân tử NH3 là: 0.769 kg/m3 với tỷ lệ giãn nở thể tích 850 - 1000 lần
Khối lượng riêng của NH3 là : 681 kg/m3 (ở nhiệt độ -33°C)
NH3 có độ hòa tan trong nước: 47% ở 0°C (89,9 g/100ml); 31% ở 25 °C; 18% ở 50°C;
Dung dịch NH3 có tính bazơ nên có độ pH > 12
Điểm sôi của dung dịch NH3 là 33,34 °C, điểm nóng chảy của NH3 là -77,7 °C, nhiệt độ tự cháy của NH3 khí là 650°C
6. Tính chất hoá học của H2SO4
6.1. H2SO4 loãng
Axit sunfuric là một axit mạnh, hóa chất này có đầy đủ các tính chất hóa học chung của axit như:
- Axit sunfuric H2SO4 làm chuyển màu quỳ tím thành đỏ.
- Tác dụng với kim loại đứng trước H (trừ Pb) tạo thành muối sunfat.
Fe + H2SO4 → FeSO4 + H2
- Tác dụng với oxit bazo tạo thành muối mới (trong đó kim loại giữ nguyên hóa trị) và nước .
FeO + H2SO4 → FeSO4 + H2O
- Axit sunfuric tác dụng với bazo tạo thành muối mới và nước.
H2SO4 + NaOH → NaHSO4 + H2O
H2SO4 + 2NaOH → Na2SO4 + 2H2O
- H2SO4 tác dụng với muối tạo thành muối mới (trong đó kim loại vẫn giữ nguyên hóa trị) và axit mới.
Na2CO3 + H2SO4 → Na2SO4 + H2O + CO2
H2SO4 + 2KHCO3 → K2SO4 + 2H2O + 2CO2
6.2. H2SO4 đặc
Axit sunfuric đặc có tính axit mạnh, oxi hóa mạnh với tính chất hóa học nổi bật như:
- Tác dụng với kim loại: Khi cho mảnh Cu vào trong H2SO4 tạo ra dung dịch có màu xanh và có khí bay ra với mùi sốc.
Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O
- Tác dụng với phi kim tạo thành oxit phi kim + H2O + SO2.
C + 2H2SO4 → CO2 + 2H2O + 2SO2 (nhiệt độ)
2P + 5H2SO4 → 2H3PO4 + 5SO2 + 2H2O
- Tác dụng với các chất khử khác.
2FeO + 4H2SO4 → Fe2(SO4)3 + SO2 + 4H2O
- H2SO4 còn có tính háo nước đặc trưng như đưa H2SO4 vào cốc đựng đường, sau phản ứng đường sẽ bị chuyển sang màu đen và phun trào với phương trình hóa học như sau.
C12H22O11 + H2SO4 → 12C + H2SO4.11H2O
7. Bài tập vận dụng liên quan
Câu 1. Có thể thu được nitơ từ phản ứng nào trong các phản ứng dưới đây?
A. Đun nóng dung dịch bão hòa natri nitrit với amoni clorua.
B. Nhiệt phân AgCl.
C. Cho bột Cu vào dung dịch HNO3 đặc nóng.
D. Cho muối NH4NO3 vào dung dịch kiềm.
Lời giải:
Đáp án A
Có thể thu được nitơ từ phản ứng đun nóng dung dịch bão hòa natri nitrit với amoni clorua
2NH4Cl + NaNO3→ N2 + NaCl + 2H2O
Câu 2. Trong phòng thí nghiệm có thể điều chế nitơ bằng phương pháp nào sau đây
A. nhiệt phân atri nitrit
B. Đun hỗn hợp NaNO2 và NH4Cl
C. thủy phân Mg3N2
D. phân hủy khí amoniac
Lời giải:
Đáp án B
Trong phòng thí nghiệm có thể điều chế nitơ bằng phương pháp đun hỗn hợp NaNO2 và NH4Cl
NaNO2 + NH4Cl → N2 + 2H2O + NaCl
Câu 3. Khi nhiệt phân, nhóm các muối nitrat cho sản phẩm kim loại, khí NO2, O2 là
A. Cu(NO3)2, Pb(NO3)2.
B. Ca(NO3)2, Hg(NO3)2, AgNO3.
C. Zn(NO3)2, AgNO3, NaNO3.
D. Hg(NO3)2, AgNO3.
Lời giải:
Đáp án D
Nếu muối nitrat của kim loại sau Cu → kim loại + NO2 + O2
Hg(NO3)2 → Hg + 2NO2 + O2
AgNO3 → Ag + NO2 + 1/2O2
Câu 4. Cho 17,4 gam muối FeCO3 tác dụng vừa đủ với dung dịch HNO3 được hỗn hợp khí CO2, NO và dung dịch X. Khi thêm dung dịch HCl (dư) vào dung dịch X, thì dung dịch thu được hòa tan tối đa bao nhiêu bột đồng kim loại, biết rằng có khí NO bay ra?
A. 14,4 gam.
B. 48 gam.
C. 16 gam.
D. 32 gam.
Lời giải:
Đáp án B
nFeCO3 = 0,15 mol ⇒ Fe(NO3)3 = 0,15 mol ⇒ nNO3- = 0,45 mol
3Cu + 8H+ + 2NO3- → Cu2+ + 2NO + 4H2O
nCu = 3/2. nNO3- = 0,675 mol
Cu + 2Fe3+ → Cu2+ + 2Fe2+
nCu = 1/2. nFe3+ = 0,075
⇒ ∑nCu = 0,075 ⇒ mCu = 48 gam
Câu 5. Nhiệt phân hoàn toàn AgNO3 thu được sản phẩm là
A. Ag, NO2, O2
B. Ag2O, NO2, O2
C. AgNO2, O2
D. Ag, Ag2O, NO2
Lời giải:
Đáp án A
Nhiệt phân hoàn toàn AgNO3 thu được sản phẩm là Ag, NO2, O2
Câu 6. Nung a gam Mg(NO3)2 đến khi phản ứng xảy ra hoàn toàn thu được 11,2 lít (đktc) hỗn hợp khí X gồm NO2 và O2. Giá trị của a là
A. 14,8.
B. 18,5.
C. 29,6.
D. 11,1.
Lời giải:
Đáp án C
Phương trình nhiệt phân Mg(NO3)2
2Mg(NO3)2 → 2MgO + 4NO2+ O2
Đặt số mol O2 là x
=> nNO2 = 4x;
nMg(NO3)2 = 2x
nhỗn hợp khí = 0,5 => nO2 + nNO2 = 5x = 0,5 => x = 0,1 => nMg(NO3)2 = 0,2
mMg(NO3)2 = 29,6 gam
Câu 7. Dẫn 4,48 lít NH3 (đktc) đi qua ống đựng 64 gam CuO nung nóng thu được chất rắn X và khí Y. Ngâm chất rắn X trong dung dịch HCl 2M dư. Tính thể tích dung dịch axit đã tham gia phản ứng ? Coi hiệu suất quá trình phản ứng là 100%.
A. 0,5 lít
B. 0,25 lít
C. 1 lít
D. 0,15 lít
Lời giải:
Đáp án A
nNH3 = 0,2 mol,
nCuO = 0,8 mol
Phương trình phản ứng :
2NH3 + 3CuO → 3Cu + N2+ 3H2O (1)
0,2 0,8 → 0,3
=> nCuO dư = 0,8 - 0,3 = 0,5 mol
X gồm Cu (0,3 mol) và CuO dư (0,5 mol)
- Phản ứng của X với dung dịch HCl :
CuO + 2HCl → CuCl2 + H2O (2)
mol: 0,5 → 1
Theo (2) và giả thiết ta suy ra VHCl = 1/2 = 0,5 lít.
Câu 8. Cặp muối nào tác dụng với dung dịch NH3 dư đều thu được kết tủa?
A. K2SO4, MgCl2.
B. AlCl3, FeCl3.
C. CuSO4, FeSO4.
D. AgNO3, Zn(NO3)2.
Lời giải:
Đáp án B
Cặp muối khi tác dụng với dung dịch NH3 dư đều tạo kết tủa là AlCl3 và FeCl3
2NH3 + AlCl3 + 3H2O → Al(OH)3 ↓ + 3NH4Cl
FeCl3 + 3 NH3 + 3 H2O → Fe(OH)3 + 3 NH4Cl
A sai vì K2SO4 không tạo kết tủa với NH3
C sai vì CuSO4 tạo kết tủa, sau đó kết tủa tan khi NH3 dư
D sai vì AgNO3, Zn(NO3)2 đều tạo kết tủa, sau đó kết tủa tan khi NH3 dư
Câu 9. Nhận biết dung dịch AlCl3 và ZnCl2 người ta dùng hóa chất nào sau đây
A. NaOH.
B. H2SO4.
C. NH3.
D. Ba(OH)2.
Lời giải:
Đáp án C
Để nhận biết AlCl3 và ZnCl2, người ta dùng dung dịch NH3 dư
AlCl3 tạo kết tủa và không tan trong NH3 dư còn ZnCl2 tạo kết tủa sau đó tan.
2NH3 + AlCl3 + 3H2O → Al(OH)3 ↓ + 3NH4Cl
Câu 10. Tính bazơ của NH3 là do
A. trên nguyên tử N còn cặp e tự do.
B. phân tử có 3 liên kết cộng hóa trị phân cực.
C. NH3 tan nhiều trong nước.
D. NH3 tác dụng với nước tạo thành NH4OH.
Lời giải:
Đáp án A
Tính bazơ của NH3 là do trên nguyên tử N còn cặp e tự do không tham gia liên kết.
Theo thuyết bronsted , bazo là chất nhận proton
Theo thuyết areniut, bazo là chất tan trong nước phân li ra ion OH-
H2O + NH3 ⇌ OH– + NH4+
Xem thêm các phương trình hóa học khác:
Xem thêm các chương trình khác:
- Các dạng bài tập Tiếng Anh thông dụng nhất
- 3000 câu hỏi ôn tập môn Tiếng Anh có đáp án
- Toàn bộ kiến thức về cụm động từ | Định nghĩa và cách dùng
- 500 đoạn văn Tiếng Anh thông dụng nhất và cách làm
- 1000 câu hỏi ôn tập môn Công nghệ có đáp án
- 1000 câu hỏi ôn tập Giáo dục công dân
- 15000 câu hỏi ôn tập môn Toán có đáp án
- Wiki Toán | Khái niệm, định lí, tính chất, dạng bài, công thức
- Tuyển tập đề thi + chuyên đề ôn thi Toán Kangaroo các cấp độ (có đáp án 2024)
- 3000 câu hỏi ôn tập môn Vật lí có đáp án
- Tổng hợp Dạng bài - Công thức môn Vật lí
- 2000 câu hỏi ôn tập môn Tin học có đáp án
- 3000 câu hỏi ôn tập môn Lịch sử có đáp án
- 3000 câu hỏi ôn tập môn Địa lí có đáp án
- 2000 câu hỏi ôn tập môn Sinh học có đáp án
- Tổng hợp Dạng bài - Công thức môn Sinh học
- Tổng hợp về các tác giả văn học
- 3000 câu hỏi ôn tập môn Ngữ văn có đáp án
- Tổng hợp kiến thức Ngữ Văn
- Tuyển tập truyện dân gian, truyền thuyết, cổ tích,... Việt Nam
- Tổng hợp các đề đọc - hiểu có đáp án chi tiết
- Trò chơi Powerpoint | Game Powerpoint
- Tổng hợp bài thu hoạch BDTX Giáo viên mầm non (2025) theo Thông tư 12
- Tổng hợp bài thu hoạch BDTX Giáo viên tiểu học (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THCS (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THPT (2025)
