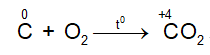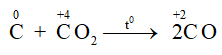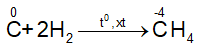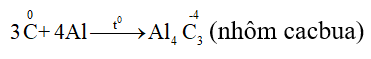C + H2SO4 → SO2 + CO2 + H2O | C ra SO2
C + H2SO4 → SO2 + CO2 + H2O là phản ứng oxi hóa khử. Bài viết này cung cấp đầy đủ thông tin về phương trình hóa học đã được cân bằng, điều kiện các chất tham gia phản ứng, hiện tượng (nếu có), ... Mời các bạn đón xem:
Phản ứng C + H2SO4 → SO2 + CO2 + H2O
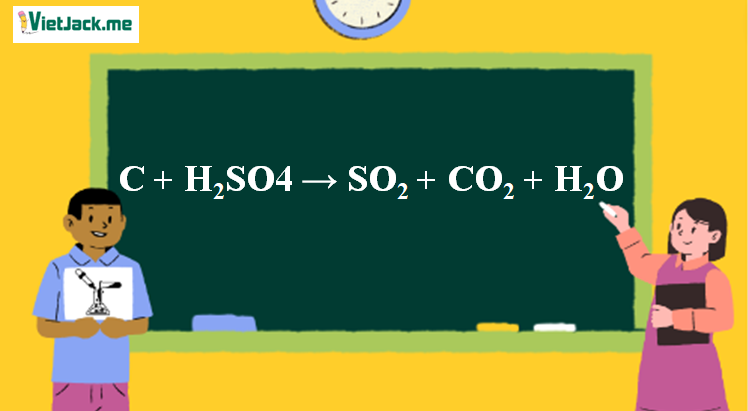
1. Phương trình phản ứng H2SO4 ra CO2
C + 2H2SO4 → 2SO2 + CO2 + 2H2O
2. Điều kiện phản ứng giữa C ra SO2
Nhiệt độ
3. Bản chất của các chất tham gia phản ứng
3.1. Bản chất của C (Cacbon)
- Trong phản ứng trên C là chất khử.
- C tác dụng được với các chất oxi hóa mạnh thường gặp H2SO4 đặc, HNO3, KNO3, KClO3, K2Cr2O7, ...
3.2. Bản chất của H2SO4 (Axit sunfuric)
- Trong phản ứng trên H2SO4 là chất oxi hoá.
- Trong H2SO4 thì S có mức oxi hóa +6 cao nhất nên H2SO4 đặc có tính axit mạnh, oxi hóa mạnh và có tính háo nước.
4. Tính chất hóa học của H2SO4 đặc
Trong H2SO4 thì S có mức oxi hóa +6 cao nhất nên H2SO4 đặc có tính axit mạnh, oxi hóa mạnh và có tính háo nước.
Có những tính chất hóa học riêng:
4.1. Axit sunfuric đặc tác dụng với kim loại trừ (Au, Pt)
Axit sunfuric tác dụng với kim loại tạo muối và nhiều sản phẩm oxi hóa khác nhau như SO2, H2S, S.
Ví dụ:
Cu + H2SO4 → CuSO4+ SO2 + H2O
Fe + H2SO4→ Fe2(SO4)3 + SO2 + H2O
Fe, Al, Cr bị thụ động hóa trong dung dịch HNO3 đặc, nguội
4.2. Tính háo nước của axit sunfuric đặc
C12H22O11 → 11H2O + 12C
4.3. Axit sunfuric đặc tác dụng với phi kim
C + 2H2SO4 đặc nóng→ CO2+ 2SO2 + 2H2O
S + 2H2SO4 đặc nóng → 3SO2 + 2H2O
5. Tính chất hóa học của C
- Trong các dạng tồn tại của C, C vô định hình hoạt động hơn cả về mặt hóa học.
- Trong các phản ứng hóa học C thể hiện hai tính chất: Tính oxi hóa và tính khử. Tuy nhiên tính khử vẫn là chủ yếu của C.
5.1. Tính khử
- Tác dụng với oxi
Ở nhiệt độ cao C lại khử CO2 theo phản ứng:
- Tác dụng với oxit kim loại:
+ C khử được oxit của các kim loại đứng sau Al trong dãy hoạt động hóa học của kim loại:
CuO + C → Cu + CO (tº)
Fe2O3 + 3C → 2Fe + 3CO (tº)
+ Với CaO và Al2O3:
CaO + 3C → CaC2 + CO (trong lò điện)
2Al2O3 + 9C → Al4C3 + 6CO (2000ºC)
- Tác dụng với các chất oxi hóa mạnh thường gặp H2SO4 đặc, HNO3, KNO3, KClO3, K2Cr2O7, ... trong các phản ứng này, C bị oxi hóa đến mức +4 (CO2).
C + 2H2SO4 đặc → CO2 + 2SO2 + 2H2O (tº)
C + 4HNO3 đặc → CO2 + 4NO2 + 2H2O (tº)
C + 4KNO3 → 2K2O + CO2 + 4NO2 (tº)
- Khi nhiệt độ cao, C tác dụng được với hơi nước:
C + H2O → CO + H2 (1000ºC)
C + 2H2O → CO2 + 2H2
5.2. Tính oxi hóa
- Tác dụng với hidro
- Tác dụng với kim loại
6. Ứng dụng của Cacbon
- Than chì được dùng làm điện cực, chất bôi trơn, ruột bút chì; …
- Kim cương được dùng làm đồ trang sức quý hiếm, mũi khoan, dao cắt kính...
- Cacbon vô định hình cũng có nhiều ứng dụng:
+ Than hoạt tính làm mặt nạ phòng độc. khử mùi,…
+ Than gỗ dùng làm chất đốt, chất khử,…
7. Bài tập vận dụng
Câu 1. Ở nhiệt độ cao, cacbon monooxit (CO) có thể khử tất cả các oxit trong dãy nào sau đây?
A. CuO, FeO, Al2O3, Fe2O3.
B. MgO, Fe3O4, CuO, PbO.
C. CaO, CuO, ZnO, Fe3O4.
D. CuO, FeO, PbO, Fe3O4
Lời giải:
Đáp án: D
Câu 2. Nhận xét nào sau đây không đúng về H2SO4?
A. H2SO4 tan tốt trong nước
B. Ở điều kiện thường H2SO4 là chất rắn.
C. H2SO4 có tính axit mạnh.
D. H2SO4 đặc có tính háo nước.
Lời giải:
Đáp án: B
Câu 3. Trong các phản ứng sau đây, hãy chọn câu kết luận không đúng về H2SO4:
A. H2SO4 loãng có đầy đủ tính chất chung của axit
B. Khi tiếp xúc với H2SO4 đặc dễ gây bỏng nặng
C. H2SO4 đặc là chất hút nước mạnh
D. Khi pha loãng axit sunfuric đặc, chỉ được cho từ từ nước và axit
Lời giải:
Đáp án: D
Câu 4. Thí nghiệm nào sau đây thu được muối sắt(III) sau khi phản ứng kết thúc?
A. Cho Fe vào dung dịch HCl dư.
B. Cho Fe(OH)2 vào dung dịch HCl dư.
C. Cho FeO vào dung dịch H2SO4 loãng, dư.
D. Cho Fe vào dung dịch H2SO4 đặc nóng, dư.
Lời giải:
Đáp án: D
Giải thích:
A. Fe + HC l→ FeCl2 + H2
B. Fe(OH)2+ HCl → FeCl2 + H2O
C. FeO + H2SO4 loãng → FeSO4 + H2O
D. Fe + H2SO4 đặc nóng dư → Fe2(SO4)3 + SO2 + H2O
Câu 5. Nhận xét nào sau đây không đúng về H2SO4?
A. H2SO4 tan tốt trong nước
B. Ở điều kiện thường H2SO4là chất rắn.
C. H2SO4 có tính axit mạnh.
D. H2SO4 đặc có tính háo nước.
Lời giải:
Đáp án: B
Câu 6. Phát biểu nào sau đây là đúng
A. Muốn pha loãng axit H2SO4 đặc, ta rót nước vào axit.
B. Lưu huỳnh trioxit vừa có tính oxi hóa vừa có tỉnh khử.
C. Hầu hết các muối sunfat đều không tan.
D. Axit H2SO4đặc có tính háo nước mạnh, nên khi sử dụng phải hết sức thận trọng.
Lời giải:
Đáp án: D
Giải thích:
Axit H2SO4 đặc có tính háo nước mạnh, nên khi sử dụng phải hết sức thận trọng.
Câu 7. Cho các nhận định sau:
(1). Có thể điều chế HX bằng phản ứng giữa NaX với H2SO4 đặc
(2). Có thể điều chế X2 bằng phản ứng giữa HX đặc với KMnO4.
(3). Phản ứng của dung dịch HX với Fe2O3 đều là phản ứng trao đổi.
(4). Đi từ F tới I nhiệt độ sôi tăng dần, nhiệt độ nóng chảy tăng dần, màu sắc đậm dần.
(5). Trong tự nhiên Clo chủ yếu tồn tại ở dạng đơn chất.
(6). Trong công nghiệp người ta sản xuất clo bằng cách điện phân dung dịch NaCl có màng ngăn xốp.
(7). Flo được dùng làm chất oxi hóa cho nhiên liệu lỏng dùng trong tên lửa.
(8). Flo được sử dụng trong công nghiệp hạt nhân để làm giàu 235U.
Số phát biểu đúng là:
A. 4
B. 5
C. 6
D. 7
Lời giải:
Đáp án: A
(4). Đi từ F tới I nhiệt độ sôi tăng dần, nhiệt độ nóng chảy tăng dần, màu sắc đậm dần.
(6). Trong công nghiệp người ta sản xuất clo bằng cách điện phân dung dịch NaCl có màng ngăn xốp.
(7). Flo được dùng làm chất oxi hóa cho nhiên liệu lỏng dùng trong tên lửa.
(8). Flo được sử dụng trong công nghiệp hạt nhân để làm giàu 235U.
Câu 8: phản ứng nào trong các phản ứng sau đây, cacbon thể hiện tính oxi hóa?
A. C + O2 → CO2
B. C + 2CuO → 2Cu + CO2
C. 3C + 4Al → Al4C3
D. C + H2O → CO + H2
Lời giải:
Đáp án: C
Câu 9. Chất nào sau đây không phải dạng thủ hình của cacbon?
A. than chì
B. thạch anh
C. kim cương
D. cacbon vô định hình
Lời giải:
Đáp án: B
Câu 10. Cho cacbon lần lượt tác dụng với Al, H2O, CuO, HNO3 đặc, H2SO4 đặc, KClO3, CO2 ở điều kiện thích hợp. Số phản ứng mà trong đó cacbon đóng vai trò chất khử là
A. 6.
B. 4.
C. 7.
D. 5.
Lời giải:
Đáp án: A
Giải thích:
C thể hiện tính khử khi tác dụng với chất oxi hóa
→ H2O , CuO, HNO3 đặc, H2SO4 đặc, KClO3 , CO2
C + 2H2O → CO2 + 2H2
2CuO + C → 2Cu + CO2
C + 4HNO3 → CO2+ 4NO2 + 2H2O
C + 2H2SO4→ 2SO2 + CO2 + 2H2O
2KClO3 + 3C → 2KCl + 3CO2
C + CO2→ 2CO
Câu 11. Nhận định nào sau đây sai?
A. Cacbon monoxit không tạo ra muối và là một chất khử mạnh.
B. Ở nhiệt độ cao cacbon có thể khử được tất cả cac oxit kim loại giải phóng kim loại.
C. than gỗ được dùng để chế thuốc súng, thuốc pháo, chất hấp phụ.
D. than muội được dùng để làm chất độn cao su, sản xuất mực in, xi đánh giầy.
Lời giải:
Đáp án: B
Câu 12. Cho m gam than (C) tác dụng với dung dịch HNO3 đặc nóng dư thu được 11,2 lít hỗn hợp X gồm 2 khí (đktc) (NO2 là sản phẩm khử duy nhất). Giá trị của m là
A. 1,2.
B. 6.
C. 2,5.
D. 3.
Lời giải:
Đáp án: A
Giải thích:
Phương trình hóa học
C + 4HNO3→ CO2 + 4NO2 + 2H2O
x → x → 4x
5x = 0,5 => x = 0,1 => m = 1,2 gam
Xem thêm các phương trình phản ứng hóa học khác:
Xem thêm các chương trình khác:
- Các dạng bài tập Tiếng Anh thông dụng nhất
- 3000 câu hỏi ôn tập môn Tiếng Anh có đáp án
- Toàn bộ kiến thức về cụm động từ | Định nghĩa và cách dùng
- 500 đoạn văn Tiếng Anh thông dụng nhất và cách làm
- 1000 câu hỏi ôn tập môn Công nghệ có đáp án
- 1000 câu hỏi ôn tập Giáo dục công dân
- 15000 câu hỏi ôn tập môn Toán có đáp án
- Wiki Toán | Khái niệm, định lí, tính chất, dạng bài, công thức
- Tuyển tập đề thi + chuyên đề ôn thi Toán Kangaroo các cấp độ (có đáp án 2024)
- 3000 câu hỏi ôn tập môn Vật lí có đáp án
- Tổng hợp Dạng bài - Công thức môn Vật lí
- 2000 câu hỏi ôn tập môn Tin học có đáp án
- 3000 câu hỏi ôn tập môn Lịch sử có đáp án
- 3000 câu hỏi ôn tập môn Địa lí có đáp án
- 2000 câu hỏi ôn tập môn Sinh học có đáp án
- Tổng hợp Dạng bài - Công thức môn Sinh học
- Tổng hợp về các tác giả văn học
- 3000 câu hỏi ôn tập môn Ngữ văn có đáp án
- Tổng hợp kiến thức Ngữ Văn
- Tuyển tập truyện dân gian, truyền thuyết, cổ tích,... Việt Nam
- Tổng hợp các đề đọc - hiểu có đáp án chi tiết
- Trò chơi Powerpoint | Game Powerpoint
- Tổng hợp bài thu hoạch BDTX Giáo viên mầm non (2025) theo Thông tư 12
- Tổng hợp bài thu hoạch BDTX Giáo viên tiểu học (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THCS (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THPT (2025)