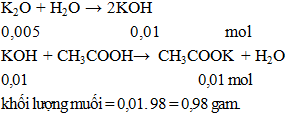K2O + CH3COOH → CH3COOK + H2O l K2O ra CH3COOK
K2O + CH3COOH → CH3COOK + H2O là phản ứng trao đổi. Bài viết này cung cấp đầy đủ thông tin về phương trình hóa học đã được cân bằng, điều kiện các chất tham gia phản ứng, hiện tượng (nếu có), ... Mời các bạn đón xem:
Phản ứng K2O + CH3COOH → CH3COOK + H2O
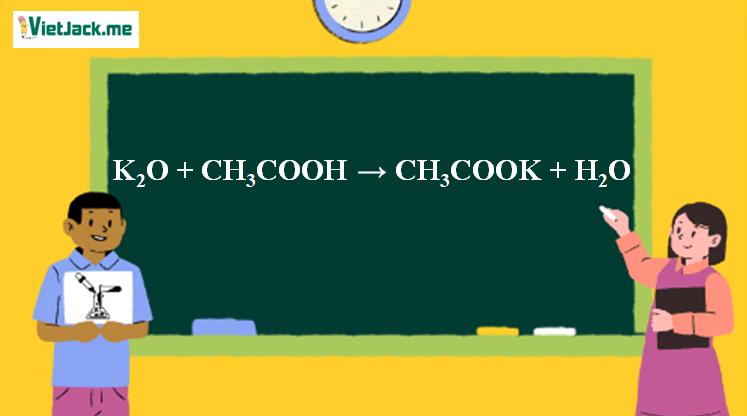
1. Phản ứng hóa học
K2O + 2CH3COOH → 2CH3COOK + H2O
2. Điều kiện phản ứng
Điều kiện thường.
3. Cách thực hiện phản ứng
Nhỏ từ từ axit axetic vào ống nghiệm có chứa K2O.
4. Hiện tượng nhận biết phản ứng
K2O có màu vàng nhạt, tan dần tạo dung dịch.
5. Bản chất của các chất tham gia phản ứng
5.1. Bản chất của K2O (Kali oxit)
K2O là oxit bazo phản ứng được với các axit hữu cơ.
5.2. Bản chất của CH3COOH (Axit axetic)
CH3COOH là một axit hữu cơ mạnh tác dụng được với rượu tạo thành este.
6. Tính chất hoá học của K2O
K2O là oxit bazo do đó mang đầy đủ tính chất hóa học của một oxit bazơ.
6.1. K2O tác dụng với nước
K2O tác dụng với nước tạo ra dung dịch kiềm KOH.
K2O + H2O → KOH
6.2. K2O tác dụng với oxit axit tạo thành muối
K2O + CO2→ K2CO3
6.3. K2O tác dụng với dung dịch axit
K2O + axit → muối + H2O
K2O + HCl → KCl + H2O
7. Tính chất vật lý của K2O
K2O là một chất bột màu trắng, không mùi, và có nhiệt độ nóng chảy khoảng 891°C
8. Tính chất hoá học của axit axetic
- Nguyên tử hydro trong nhóm cacboxyl có thể cung cấp một proton H+, làm chúng có tính chất axit, tuy nhiên, axit axetic là một axit yếu thuộc nhóm axit monoprotic. Dung dịch có nồng độ mol 1 M (giấm ăn trong gia đình) có độ pH là 2.4, tức chỉ có 0.44 % phân tử axit axetic bị phân ly.
- Axit axetic lỏng là dung môi phân cực với hằng số điện ly khoảng 6.2.
- Nó có khả năng hòa tan các hợp chất không phân cực như dầu, các nguyên tố lưu huỳnh, iot và các dung môi phân cực như nước, chloroform, hexan.
- Axit axetic CH3COOH (etanoic) là một axit hữu cơ, mạnh hơn axit cacbonic. Nó được tào thành bằng việc liên kết nhóm methyl CH3 với cacboxyl COOH.
- Axit axetic tác dụng với bazo, cacbonat và bicacbonat để tạo ra axetat kim loại tương ứng, nước và cacbonic (phổ biến nhất là natri bicacbonat với giấm ăn):
NaHCO3 + CH3COOH → CH3COONa + CO2 + H2O
- Trừ crom (II) axetat, tất cả các axetat khác đều tan được trong nước.
- Tác dụng với kiềm tạo ra nước và ethanoat kim loại:
NaOH + CH3COOH → CH3COONa + H2O
- Axit axetic phân hủy ở nhiệt độ lớn hơn 440oC tạo thành cacbonic, metan hoặc ethenon và nước.
- Tác dụng với rượu tạo thành este:
ROH + CH3COOH → CH3COOR + H2O
- Axit axetic làm ăn mòn các kim loại và tạo ra khí hydro và các muối axetat:
Mg + 2CH3COOH → (CH3COO)2Mg + H2
- Nhôm thụ động với axit axetic do khi phản ứng, nó tạo ra lớp màng mỏng nhôm oxit trên bề mặt, ngăn chặn sự ăn mòn. Vì vậy, các nhà sản xuất vẫn thường dùng bình chứa bằng nhôm để đựng dung dịch này.
- Phản ứng thế halogen vào gốc hydrocacbon ( 90 - 100oC):
Cl2 + CH3COOH → ClCH2COOH + HCl
- Tác dụng với axetylen (xúc tác thủy ngân, nhiệt độ 70 - 80oC) thành etyl diaxetat:
C2H2 + 2CH3COOH → CH3CH(OCOCH3)2
- Tác dụng với amoniac tạo thành amid:
NH3 + CH3COOH → NH3CH3COOHNH4
- Phản ứng decacboxyl hóa thành axeton (Xúc tác mangan oxit, nhiệt độ):
C2H2+ CH3COOH → CH2CHOCOCH3
9. Câu hỏi vận dụng
Câu 1. K2O không phản ứng với dung dịch nào sau đây?
A. HCOOH. B. CH3COOH C. Na2CO3. D. H2S.
Lời giải:
Na2CO3 không phản ứng với K2O.
Đáp án C.
Câu 2. Kali axetat có công thức là
A. HCOOK. B. CH3COOK. C. K2CO3. D. KHS.
Lời giải:
CH3COOK kali axetat.
Đáp án B.
Câu 3. Cho 0,47g K2O hòa tan vào nước được dung dịch X. Lượng dung dịch X trên phản ứng vừa đủ với dung dịch CH3COOH. Khối lượng muối có trong dung dịch thu được sau phản ứng là
A. 1,58 gam. B, 0,98 gam. C. 0,78 gam. D. 1,26 gam.
Lời giải:
Đáp án B.
Xem thêm các phương trình hóa học khác:
Xem thêm các chương trình khác:
- Các dạng bài tập Tiếng Anh thông dụng nhất
- 3000 câu hỏi ôn tập môn Tiếng Anh có đáp án
- Toàn bộ kiến thức về cụm động từ | Định nghĩa và cách dùng
- 500 đoạn văn Tiếng Anh thông dụng nhất và cách làm
- 1000 câu hỏi ôn tập môn Công nghệ có đáp án
- 1000 câu hỏi ôn tập Giáo dục công dân
- 15000 câu hỏi ôn tập môn Toán có đáp án
- Wiki Toán | Khái niệm, định lí, tính chất, dạng bài, công thức
- Tuyển tập đề thi + chuyên đề ôn thi Toán Kangaroo các cấp độ (có đáp án 2024)
- 3000 câu hỏi ôn tập môn Vật lí có đáp án
- Tổng hợp Dạng bài - Công thức môn Vật lí
- 2000 câu hỏi ôn tập môn Tin học có đáp án
- 3000 câu hỏi ôn tập môn Lịch sử có đáp án
- 3000 câu hỏi ôn tập môn Địa lí có đáp án
- 2000 câu hỏi ôn tập môn Sinh học có đáp án
- Tổng hợp Dạng bài - Công thức môn Sinh học
- Tổng hợp về các tác giả văn học
- 3000 câu hỏi ôn tập môn Ngữ văn có đáp án
- Tổng hợp kiến thức Ngữ Văn
- Trò chơi Powerpoint | Game Powerpoint
- Tổng hợp bài thu hoạch BDTX Giáo viên mầm non (2024) theo Thông tư 12
- Tổng hợp bài thu hoạch BDTX Giáo viên tiểu học (2024)
- Tổng hợp bài thu hoạch BDTX Giáo viên THCS (2024)
- Tổng hợp bài thu hoạch BDTX Giáo viên THPT (2024)