ZnO + H2SO4 → ZnSO4 + H2O | ZnO ra ZnSO4
ZnO + H2SO4 → ZnSO4 + H2O là phản ứng trao đổi. Bài viết này cung cấp đầy đủ thông tin về phương trình hóa học đã được cân bằng, điều kiện các chất tham gia phản ứng, hiện tượng (nếu có), ... Mời các bạn đón xem:
Phản ứng ZnO + H2SO4 → ZnSO4 + H2O
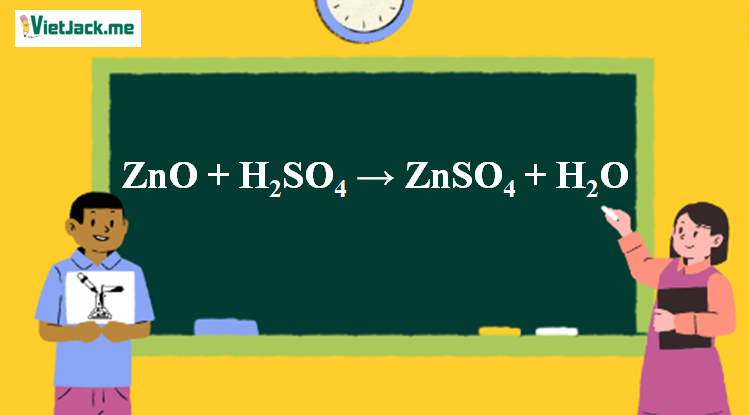
1. Phương trình phản ứng ZnO tác dụng H2SO4
ZnO + H2SO4 → ZnSO4 + H2O
2. Điều kiện phản ứng xảy ra giữa ZnO và dung dịch H2SO4
Nhiệt độ thường
3. Bản chất của các chất tham gia phản ứng
3.1. Bản chất của ZnO (Kẽm oxit)
ZnO là một oxit lưỡng tính. Nó gần như không hòa tan trong nước và rượu, nhưng nó lại hòa tan trong hầu hết các axit.
3.2. Bản chất của H2SO4 (Axit sunfuric)
H2SO4 là một axit mạnh tác dụng với oxit bazo tạo thành muối và nước.
4. Mở rộng kiến thức về ZnO
4.1. Tính chất vật lí & nhận biết
- Tính chất vật lí:
- Ở điều kiện thường kẽm oxit có dạng bột trắng mịn, khi nung trên 300oC chuyển sang màu vàng, sau khi làm lạnh thì trở lại màu trắng.
- Khi đưa vào mạng tinh thể một lượng nhỏ kim loại hóa trị I hoặc hóa trị III thì nó trở thành chất bán dẫn.
- Hơi của ZnO rất độc.
- Nhận biết: Hòa tan ZnO trong dung dịch NaOH, thấy chất rắn tan dần:
2NaOH + ZnO → Na2ZnO2 + H2O
4.2. Tính chất hóa học
Mang tính chất hóa học của oxit lưỡng tính
Tác dụng với axit
ZnO + 2HCl →ZnCl2 + H2O
ZnO + 2HNO3→ Zn(NO3)2 + H2O
Tác dụng với dung dịch bazơ
2NaOH + ZnO → Na2ZnO2 + H2O
Tác dụng với chất khử mạnh: Al, CO, H2
3ZnO + 2Al 
ZnO + H2 
4.3. Điều chế
Đốt cháy kẽm trong oxi
2Zn + O2 
4.4. Ứng dụng
Kẽm Oxit ứng dụng trong quá trình sản xuất Cao su.
Khoảng 50% của ZnO sử dụng là trong ngành công nghiệp cao su. Kẽm oxit với axit stearic được sử dụng trong lưu hóa cao su và ngoài ra, kẽm oxit cũng bảo vệ cao su khỏi nấm và ánh sáng UV.
Kẽm Oxit ứng dụng trong ngành xây dựng
Oxit kẽm được sử dụng cho sản xuất bê tông . Bổ sung ZnO cải thiện thời gian xử lý và sức đề kháng của bê tông so với nước.
Kẽm Oxit ứng dụng trong ngành công nghiệp mỹ phẩm
Oxit kẽm có thể được sử dụng trong thuốc mỡ và kem chống nắng để bảo vệ da khỏi bị cháy nắng và tổn thương da gây ra bởi ánh sáng của tia cực tím.
Oxit kẽm còn dùng để tạo ra dầu gội trị gàu và nấm da đầu hoặc các loại phấn rôm cho em bé để tránh tình trạng bé bị rôm sẩy.
Kẽm Oxit ứng dụng trong Y tế
Kẽm oxit khi được dùng chung với eugenol sẽ tạo thành eugenol kẽm oxit được ứng dụng trong nha khoa.
Kẽm Oxit ứng dụng trong ngành công nghiệp khác
Kẽm oxit có thể khử mùi và kháng khuẩn nên được thêm vào các vật liệu khác nhau bao gồm vải bông, cao su, bao bì thực phẩm.
Kẽm oxit là một thành phần của bộ lọc thuốc lá để loại bỏ các thành phần được lựa chọn từ khói thuốc lá.phụ gia thực phẩm
Oxit kẽm còn là chất phụ gia thực phẩm, được thêm vào nhiều sản phẩm thực phẩm, bao gồm ngũ cốc ăn sáng , như là một nguồn chất dinh dưỡng cần thiết.
5. Tính chất hoá học của H2SO4
5.1. H2SO4 loãng
Axit sunfuric là một axit mạnh, hóa chất này có đầy đủ các tính chất hóa học chung của axit như:
- Axit sunfuric H2SO4 làm chuyển màu quỳ tím thành đỏ.
- Tác dụng với kim loại đứng trước H (trừ Pb) tạo thành muối sunfat.
Fe + H2SO4 → FeSO4 + H2
- Tác dụng với oxit bazo tạo thành muối mới (trong đó kim loại giữ nguyên hóa trị) và nước .
FeO + H2SO4 → FeSO4 + H2O
- Axit sunfuric tác dụng với bazo tạo thành muối mới và nước.
H2SO4 + NaOH → NaHSO4 + H2O
H2SO4 + 2NaOH → Na2SO4 + 2H2O
- H2SO4 tác dụng với muối tạo thành muối mới (trong đó kim loại vẫn giữ nguyên hóa trị) và axit mới.
Na2CO3 + H2SO4 → Na2SO4 + H2O + CO2
H2SO4 + 2KHCO3 → K2SO4 + 2H2O + 2CO2
5.2. H2SO4 đặc
Axit sunfuric đặc có tính axit mạnh, oxi hóa mạnh với tính chất hóa học nổi bật như:
- Tác dụng với kim loại: Khi cho mảnh Cu vào trong H2SO4 tạo ra dung dịch có màu xanh và có khí bay ra với mùi sốc.
Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O
- Tác dụng với phi kim tạo thành oxit phi kim + H2O + SO2.
C + 2H2SO4 → CO2 + 2H2O + 2SO2 (nhiệt độ)
2P + 5H2SO4 → 2H3PO4 + 5SO2 + 2H2O
- Tác dụng với các chất khử khác.
2FeO + 4H2SO4 → Fe2(SO4)3 + SO2 + 4H2O
- H2SO4 còn có tính háo nước đặc trưng như đưa H2SO4 vào cốc đựng đường, sau phản ứng đường sẽ bị chuyển sang màu đen và phun trào với phương trình hóa học như sau.
C12H22O11 + H2SO4 → 12C + H2SO4.11H2O
6. Bài tập vận dụng liên quan
Câu 1. Axit H2SO4 tác dụng được với dãy chất nào sau đây?
A. Cu, CuO, NaOH
B. Ag, ZnO, NaOH
C. Fe, ZnO, NaOH
D. Cu, ZnO, NaOH
Lời giải:
Câu 2. Kim loại nào sau đây không phản ứng được với H2SO4 đặc nguội
A. Cu
B. Ag
C. Fe
D. Zn
Lời giải:
Câu 3. Cho 16 gam ZnO tác dụng hết với V lít H2SO4 loãng sau phản ứng thu được m gam muối. Tính giá trị m
A. 16,1 gam
B. 32,2 gam
C. 24,15 gam
D. 48,3 gam
Lời giải:
Câu 4. Cách pha loãng H2SO4 đặc sao cho đúng và an toàn
A. rót từ từ axit vào nước và khuấy đều
B. rót nhanh axit vào nước và khuấy đều
C. rót từ từ nước vào axit và khuấy đều
D. rót nhanh nước vào axit và khuấy đều
Lời giải:
Xem thêm các phương trình hóa học khác:
Xem thêm các chương trình khác:
- Các dạng bài tập Tiếng Anh thông dụng nhất
- 3000 câu hỏi ôn tập môn Tiếng Anh có đáp án
- Toàn bộ kiến thức về cụm động từ | Định nghĩa và cách dùng
- 500 đoạn văn Tiếng Anh thông dụng nhất và cách làm
- 1000 câu hỏi ôn tập môn Công nghệ có đáp án
- 1000 câu hỏi ôn tập Giáo dục công dân
- 15000 câu hỏi ôn tập môn Toán có đáp án
- Wiki Toán | Khái niệm, định lí, tính chất, dạng bài, công thức
- Tuyển tập đề thi + chuyên đề ôn thi Toán Kangaroo các cấp độ (có đáp án 2024)
- 3000 câu hỏi ôn tập môn Vật lí có đáp án
- Tổng hợp Dạng bài - Công thức môn Vật lí
- 2000 câu hỏi ôn tập môn Tin học có đáp án
- 3000 câu hỏi ôn tập môn Lịch sử có đáp án
- 3000 câu hỏi ôn tập môn Địa lí có đáp án
- 2000 câu hỏi ôn tập môn Sinh học có đáp án
- Tổng hợp Dạng bài - Công thức môn Sinh học
- Tổng hợp về các tác giả văn học
- 3000 câu hỏi ôn tập môn Ngữ văn có đáp án
- Tổng hợp kiến thức Ngữ Văn
- Tuyển tập truyện dân gian, truyền thuyết, cổ tích,... Việt Nam
- Tổng hợp các đề đọc - hiểu có đáp án chi tiết
- Trò chơi Powerpoint | Game Powerpoint
- Tổng hợp bài thu hoạch BDTX Giáo viên mầm non (2025) theo Thông tư 12
- Tổng hợp bài thu hoạch BDTX Giáo viên tiểu học (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THCS (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THPT (2025)
