KMnO4 → K2MnO4 + MnO2 + O2 l KMnO4 ra K2MnO4 l KMnO4 ra O2 | KMnO4 ra MnO2 | KMnO4 ra O2
KMnO4 → K2MnO4 + MnO2 + O2 là phản ứng nhiệt phân. Bài viết này cung cấp đầy đủ thông tin về phương trình hóa học đã được cân bằng, điều kiện các chất tham gia phản ứng, hiện tượng (nếu có), ... Mời các bạn đón xem:
Phản ứng KMnO4 → K2MnO4 + MnO2 + O2
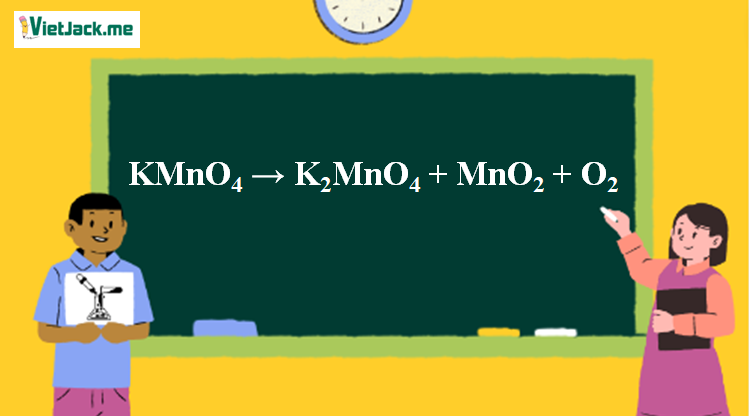
1. Phương trình nhiệt phân KMnO4
2KMnO4 K2MnO4 + MnO2 + O2
2. Điều kiện để phản ứng KMnO4 ra O2
Nhiệt độ
3. Bản chất của KMnO4 (Thuốc tím) trong phản ứng
KMnO4 là chất oxi hoá mạnh bị phân huỷ bởi nhiệt độ cao.
4. Tính chất hoá học của KMnO4
Vì là chất oxi hóa mạnh nên KMnO4 có thể phản ứng với kim loại hoạt động mạnh, axit hay các hợp chất hữu cơ dễ dàng.
4.1. Phản ứng KMnO4 phân hủy
2KMnO4 → K2MnO4+ MnO2 + O2
Khi pha loãng tinh thể pemanganat dưới ánh sáng mặt trời trực tiếp, oxi được giải phóng
4KMnO4 + 2H2O → 4KOH + 4MnO2+ 3O2
4.2. Phản ứng với axit
KMnO4 có thể phản ứng với nhiều axit mạnh như H2SO4, HCl hay HNO3, các phương trình phản ứng minh họa gồm:
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
3K2MnO4+ 4HNO3 → 2KMnO4 + MnO2 + 4KNO3 + 2H2O
4.3. Phản ứng với bazơ
Thuốc tím có thể tác dụng với nhiều dung dịch kiềm hoạt động mạnh như KOH, NaOH, phương trình phản ứng minh họa:
4KMnO4 + 4KOH → 4K2MnO4+ 2H2O + O2
4.4. Tính chất oxy hóa của KMnO4
Vì thuốc tím là chất oxy hóa mạnh nên có thể phản ứng với nhiều loại dung dịch và cho ra nhiều sản phẩm khác nhau.
- Trong môi trường axit, mangan bị khử thành Mn2+
2KMnO4 + 5Na2SO3 + 3H2SO4 → 2MnSO4 + 5Na2SO4 + K2SO4 + 3H2O
- Trong môi trường trung tính, tạo thành MnO2 có cặn màu nâu.
2KMnO4 + 3K2SO3 + H2O → 3K2SO4 + 2MnO2 + 2KOH
- Trong môi trường kiềm, bị khử thành MnO42-
2KMnO4 + Na2SO3 + 2KOH → 2K2MnO4 + Na2SO4 + H2O
4.5. Ứng dụng của KMnO4
- Ứng dụng trong y tế
KMnO4 Thuốc tím được ứng dụng khá phổ biến trong ngành y tế.
Thuốc tím được dùng làm thuốc khử trùng, sát khuẩn hiệu quả và là thuốc diệt nấm.
Được sử dụng trong điều trị các bệnh ngoài da như eczema, viêm da, mụn trứng cá, nấm,…
Thuốc tím pha loãng có thể điều trị các vết thương có mủ, rỉ nước và phồng rộp.
- Ứng dụng trong thực phẩm
Bởi đặc tính diệt khuẩn, Kali Pemanganat có tác dụng làm sạch vi khuẩn khi rửa rau sống, sát khuẩn thực phẩm. Bảo quản thực phẩm được sạch sẽ, an toàn cho người sử dụng. Ngoài ra KMnO4 còn làm giảm khả năng mắc bệnh tả và các bệnh liên quan đến nước khác cũng có thể được giảm thiểu bằng cách rửa trái cây, rau và dụng cụ nấu ăn bằng dung dịch kali permanganat pha loãng.
- Làm sạch nước
Được sử dụng khá nhiều trong chăn nuôi ao hồ. Nó giúp làm trong nước nhờ đặc tính oxi hóa cao. Nó loại bỏ magie và sắt từ nước đồng thời loại bỏ các bụi bẩn gây ra trong các thiết bị và đường ống nước. Nó được sử dụng khá nhiều cho các nguồn nước đến từ các nguồn đất sâu.
- Một vài những ứng dụng khác
KMnO4 được dùng làm chất oxi hóa trong hóa học hữu cơ và hóa học vô cơ
Là một chất hấp thụ khí gas hiệu quả
Chẩy trắng quần áo
Chất oxi hóa của đường saccharin, vitamin C v.v…
Chất làm bay màu của tinh bột, vải dệt, chất béo.
Ứng dụng trong ngành cơ khí luyện kim.
5. Câu hỏi bài tập liên quan
Câu 1. Phát biểu nào sau đây sai?
A. Khí oxi không màu, không mùi, nặng hơn không khí.
B. Khí ozon màu xanh nhạt, có mùi đặc trưng.
C. Ozon là một dạng thù hình của oxi, có tính oxi hóa mạnh hơn oxi.
D. Ozon và oxi đều được dùng để khử trùng nước sinh hoạt.
Lời giải:
A đúng Khí oxi không màu, không mùi, nặng hơn không khí.
B đúng Khí ozon màu xanh nhạt, có mùi đặc trưng.
C đúng Ozon là một dạng thù hình của oxi, có tính oxi hóa mạnh hơn oxi.
D sai vì Chỉ có ozon dùng để khử trùng nước sinh hoạt
Câu 2. Phản ứng tạo O3 từ O2 cần điều kiện:
A. tia lửa điện hoặc tia cực tím
B. Xúc tác Fe
C. Áp suất cao
D. Nhiệt độ cao
Lời giải:
Điều kiện phản ứng: Tia cực tím (UV : Ultra Violet)
Trong tự nhiên Ôzôn được hình thành từ phân tử Oxy do tác động từ tia cực tím UV, phóng điện (Tia sét) trong khí quyển, và có nồng độ thấp trong bầu khí quyển trái đất.
Khi có sấm sét, hiệu điện thế cao chạy qua không trung làm phân tách cấu tạo của phân oxy (O2) thành các oxy nguyên tử (O). Các nguyên tử này kết hợp với phân tử ôxy bên cạnh tạo nên O3, gọi là ozone.
Câu 3. Phản ứng điều chế oxi trong phòng thí nghiệm là:
A. 2KI + O3 + H2O → I2 + 2KOH + O2
B. 5nH2O + 6nCO2 → (C6H10O5)n + 6nO2
C. 2H2O 2H2 + O2
D. 2KMnO4 → K2MnO4 + MnO2 + O2
Lời giải:
Phản ứng điều chế oxi trong phòng thí nghiệm là:
2KMnO4 → K2MnO4 + MnO2 + O2
Câu 4. Dãy gồm các chất đều tác dụng được với oxi là
A. Mg, Al, C, C2H5OH
B. Al, P, Cl2, CO
C. Au, C, S, CO
D. Fe, Pt, C, C2H5OH
Lời giải:
Mg + O2 → MgO
4Al + 3O2→ 2Al2O3
2C + O2 → 2CO
C2H5OH + 2O2 → 2CO2 + 3H2O
Câu 5. Trong không khí, oxi chiếm bao nhiêu phần trăm thể tích?
A. 21%
B. 25%
C. 30%
D. 78%
Lời giải:
Thành phần của không khí
Không khí là một hỗn hợp khí trong đó : oxi chiếm 21% về thể tích (khoảng 1/5 về thể tích không khí), khí nitơ chiếm 78% và các khí khác như hơi nước, khí cacbonic, một số khí hiếm như Ne, Ar, bụi khói chiếm khoảng 1% thể tích không khí.
Câu 6. Phát biểu nào dưới đây đúng: ở nhiệt độ thường
A. O2 không oxi hóa được Ag, O3 oxi hóa được Ag.
B. O2 oxi hóa được Ag, O3 không oxi hóa được Ag.
C. Cả O2 và O3 đều không oxi hóa được Ag.
D. Cả O2 và O3 đều oxi hóa được Ag.
Lời giải:
Câu 7. Đốt cháy hoàn toàn 8,7 gam hỗn hợp Mg và Al trong khí oxi (dư) thu được 15,1 gam hỗn hợp oxit. Thể tích khí oxi (đktc) đã tham gia phản ứng là
A. 17,92 lít.
B. 8,96 lít.
C. 11,20 lít.
D. 4,48 lít.
Lời giải:
Bảo toàn khối lượng: nO2 = 15,2-8,732= 0,2 (mol)
⇒ V = 0,2. 22,4 = 4,48 (lít)
Câu 8. Thêm 1,5 gam MnO2 vào 98,5 gam hỗn hợp X gồm KCl và KClO3. Trộn kĩ và đun hỗn hợp đến phản ứng hoàn toàn, thu được chất rắn cân nặng 76 gam. Khối lượng KCl trong 98,5 gam X là
A. 74,50 gam.
B. 13,75 gam.
C. 122,50 gam.
D. 37,25 gam.
Lời giải:
Bảo toàn khối lượng: mO2 = 1,5 + 98,5 – 76 = 24 (gam)
⇒ nO2= 2432= 0,75 (mol)
2KClO3 → 2KCl + 3O2 ↑
⇒ mKCl = 98,5 – 0,5.122,5 = 37,25 (gam)
Câu 9. Người ta thu khí oxi bằng cách đấy không khí là dựa vào tính chất nào?
A. Oxi tan trong nước
B. Oxi nặng hơn không khí
C. Oxi không mùi, không màu, không vị
D. Khí oxi dễ trộn lẫn trong không khí
Lời giải:
Câu 10. Muối Fe2+ làm mất màu dung dịch KMnO4 trong môi trường axit tạo ra ion Fe3+ , còn Fe3+ tác dụng với I- tạo ra I2 và Fe2+. Sắp xếp các chất và ion Fe3+, I2 và MnO4- theo thứ tự tăng dần tính oxi hóa:
A. I2 < MnO4- < Fe3+
B. MnO4- < Fe3+ < I2
C. Fe3+ < I2 < MnO4-
D. I2 < Fe3+ < MnO4-
Lời giải:
Fe2+ bị KMnO4 oxi hóa thành Fe3+ => tính oxi hóa của MnO4- > Fe3+
Fe3+ + I → I2 + Fe2+ => tính oxi hóa của Fe3+ > I2
=> Tính oxi hóa : MnO4- > Fe3+ > I2
Câu 11. Chất nào sau đây làm mất màu dung dịch KMnO4 khi đun nóng?
A. benzen
B. toluen
C. propan
D. metan
Lời giải:
Chất nào sau đây làm mất màu dung dịch KMnO4 khi đun nóng toluen
Phương trình hóa học
C6H5CH3+ 2KMnO4→ H2O + KOH + 2MnO2 + C6H5COOK
Câu 12. Nhỏ từ từ đến dư dung dịch FeSO4 đã được axit hóa bằng H2SO4 vào dung dịch KMnO4. Hiện tượng quan sát được là
A. dung dịch màu tím hồng bị nhạt dần rồi chuyển sang màu vàng
B. dung dịch màu tím hồng bị nhạt dần đến không màu
C. dung dịch màu tím hồng bị chuyển dần sang nâu đỏ
D. màu tím bị mất ngay. Sau đó dần dần xuất hiện trở lại thành dung dịch có màu hồng
Lời giải:
Phương trình phản ứng hóa học
10FeSO4 + 8H2SO4 + 2KMnO4 → 5Fe2(SO4)3 + 2MnSO4 + 8H2O + K2SO4.
Chú ý: muối Fe2(SO4)3 và FeCl3 có màu vàng
Câu 13. A có công thức phân tử là C8H8, tác dụng với dung dịch KMnO4 ở nhiệt độ thường tạo ra ancol 2 chức. 1 mol A tác dụng tối đa với:
A. 4 mol H2; 1 mol brom.
B. 3 mol H2; 1 mol brom.
C. 3 mol H2; 3 mol brom.
D. 4 mol H2; 4 mol brom.
Lời giải:
Tác dụng với dung dịch KMnO4 ở nhiệt độ thường tạo ra ancol 2 chức => chứa nối đôi C=C
=> A là C6H5-CH=CH2 (stiren)
=> 1 mol A tác dụng tối đa với 4 mol H2; 1 mol brom.
Câu 14. Phát biểu nào sau đây đúng?
A. Ozon có tính oxi hóa mạnh nên được dùng để sát khuẩn nước sinh hoạt, tẩy trắng tinh bột, dầu ăn và nhiều chất khác.
B. Oxi và ozon đều có tính oxi hóa mạnh nhưng tính oxi hóa của oxi mạnh hơn ozon.
C. Fe tác dụng với Cl2 và H2SO4 loãng đều tạo ra muối sắt (II).
D. H2S chỉ có tính oxi hóa và H2SO4 chỉ có tính khử.
Lời giải:
A. Ozon có tính oxi hóa mạnh nên được dùng để sát khuẩn nước sinh hoạt, tẩy trắng tinh bột, dầu ăn và nhiều chất khác: Đúng.
B. Oxi và ozon đều có tính oxi hóa mạnh nhưng tính oxi hóa của oxi mạnh hơn ozon: Sai. Vì ozon có tính oxi hóa mạnh hơn oxi.
C. Fe tác dụng với Cl2 và H2SO4 loãng đều tạo ra muối sắt (II): Sai.
D. H2S chỉ có tính oxi hóa và H2SO4 chỉ có tính khử:Sai. Vì H2S chỉ thể hiện tính khử, H2SO4 chỉ thể hiện tính oxi hóa.
Câu 15. Cho các phản ứng: (1) Na2S + HCl ; (2) F2 + H2O; (3) MnO2 + HCl đặc; (4) Cl2 + dung dịch H2S. Các phản ứng tạo ra đơn chất là
A. (1), (2), (4).
B. (2), (3), (4).
C. (1), (2), (3).
D. (1), (3), (4).
Lời giải:
(1) Na2S + 2HCl → 2NaCl + H2S
(2) 2F2 + 2H2O → 4HF + O2
(3) MnO2+ 4HCl đặc → MnCl2 + Cl2 + 2H2O
(4) Cl2 + H2S → 2HCl + S
=> các phản ứng tạo ra đơn chất là: (2), (3), (4)
Câu 16. Dãy các chất đều làm mất màu dung dịch thuốc tím là
A. Etilen, axetilen, anđehit fomic, stiren
B. Axeton, etilen, anđehit axetic, cumen
C. Benzen, but-1-en, axit fomic, toluen
D. Butan, but-1-in, stiren, axit axetic
Lời giải:
3C2H4 + 2KMnO4 + 4H2O → 3C2H4(OH)2 + 2MnO2 + 2KOH
3C2H2 + 8KMnO4+ 4H2O → 3(COOH)2 + 8MnO2 + 8KOH
2KMnO4 + 3HCHO + H2O → 3HCOOH + 2KOH + 2MnO2
3C6H5-CH=CH2 + 10KMnO4 → 3C6H5COOK + 3K2CO3 + 10MnO2 + KOH + 4H2O
Xem thêm các phương trình hóa học khác:
Mg + HNO3 → Mg(NO3)2 + NO2 + H2O
Xem thêm các chương trình khác:
- Các dạng bài tập Tiếng Anh thông dụng nhất
- 3000 câu hỏi ôn tập môn Tiếng Anh có đáp án
- Toàn bộ kiến thức về cụm động từ | Định nghĩa và cách dùng
- 500 đoạn văn Tiếng Anh thông dụng nhất và cách làm
- 1000 câu hỏi ôn tập môn Công nghệ có đáp án
- 1000 câu hỏi ôn tập Giáo dục công dân
- 15000 câu hỏi ôn tập môn Toán có đáp án
- Wiki Toán | Khái niệm, định lí, tính chất, dạng bài, công thức
- Tuyển tập đề thi + chuyên đề ôn thi Toán Kangaroo các cấp độ (có đáp án 2024)
- 3000 câu hỏi ôn tập môn Vật lí có đáp án
- Tổng hợp Dạng bài - Công thức môn Vật lí
- 2000 câu hỏi ôn tập môn Tin học có đáp án
- 3000 câu hỏi ôn tập môn Lịch sử có đáp án
- 3000 câu hỏi ôn tập môn Địa lí có đáp án
- 2000 câu hỏi ôn tập môn Sinh học có đáp án
- Tổng hợp Dạng bài - Công thức môn Sinh học
- Tổng hợp về các tác giả văn học
- 3000 câu hỏi ôn tập môn Ngữ văn có đáp án
- Tổng hợp kiến thức Ngữ Văn
- Tuyển tập truyện dân gian, truyền thuyết, cổ tích,... Việt Nam
- Tổng hợp các đề đọc - hiểu có đáp án chi tiết
- Trò chơi Powerpoint | Game Powerpoint
- Tổng hợp bài thu hoạch BDTX Giáo viên mầm non (2025) theo Thông tư 12
- Tổng hợp bài thu hoạch BDTX Giáo viên tiểu học (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THCS (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THPT (2025)
