S + H2SO4 → SO2 + H2O l H2SO4 ra SO2
S + H2SO4 → SO2 + H2O là phản ứng oxi hóa khử. Bài viết này cung cấp đầy đủ thông tin về phương trình hóa học đã được cân bằng, điều kiện các chất tham gia phản ứng, hiện tượng (nếu có), ... Mời các bạn đón xem:
Phản ứng S + H2SO4 → SO2 + H2O
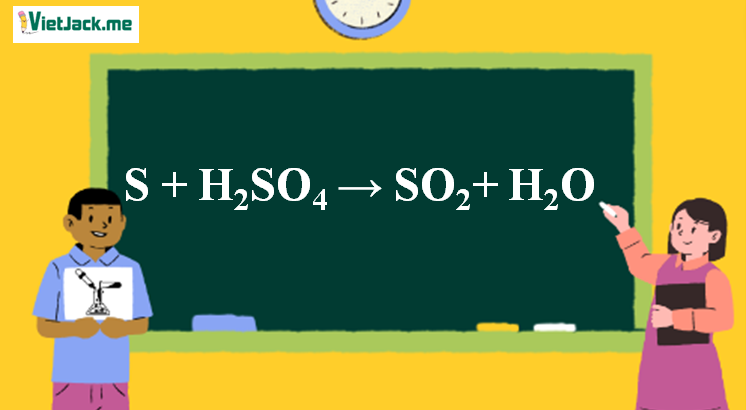
1. Phương trình phản ứng H2SO4 ra SO2
S + 2H2SO4 → 3SO2 + 2H2O
2. Điều kiện để S + H2SO4 đặc
Nhiệt độ
3. Cách tiến hành để H2SO4 tạo ra SO2
Nhỏ từ từ H2SO4 đặc vào ống nghiệm đựng sẵn bột lưu huỳnh.
4. Hiện tượng phản ứng khi tiến hành H2SO4 ra SO2
Chất rắn màu vàng Lưu huỳnh (S) tan dần và xuất hiện khí mùi hắc Lưu huỳnh dioxit (SO2) làm sủi bọt khí, các bạn học sinh phải hết lưu ý SO2 là một khí độc do đó trong quá trình làm thí nghiệm cần dùng bông tẩm kiềm tránh khí SO2 thoát ra ngoài.
5. Bản chất của các chất tham gia phản ứng
5.1. Bản chất của S (Lưu huỳnh)
- Trong phản ứng trên S là chất khử.
- S thể hiện tính khử khi tác dụng với các chất có tính oxi hoá mạnh như H2SO4 đặc, HNO3 đặc, ...
5.2. Bản chất của H2SO4 (Axit sunfuric)
- Trong phản ứng trên H2SO4 là chất oxi hoá.
- Trong H2SO4 thì S có mức oxi hoá +6 cao nhất nên H2SO4 đặc có tính axit mạnh, oxi hoá mạnh.
6. Tính chất hóa học của lưu huỳnh
Nguyên tử S có 6e lớp ngoài cùng, trong đó có 2e độc thân.
- Khi tham gia phản ứng hóa học, số oxi hóa của lưu huỳnh có thể giảm hoặc tăng: −2; 0; +4; +6.
⟹ Lưu huỳnh có tính oxi hóa và tính khử.
6.1. Lưu huỳnh có tính oxi hóa
Khi lưu huỳnh tác dụng với kim loại hoặc hiđro, số oxi hóa của lưu huỳnh từ 0 giảm xuống −2
S0 + 2e → S-2
S thể hiện tính oxi hóa khi tác dụng với kim loại và hidro.
-
Tác dụng với hiđro:
H2 + S → H2S (350oC)
Lưu huỳnh tác dụng với khí hiđro tạo thành khí hiđro sunfua.
-
Tác dụng với kim loại (có to, tạo sản phẩm có số oxh thấp của kim loại).
Fe + S FeS
Zn + S ZnS
Hg + S → HgS
(Thủy phân sunfua, phản ứng xảy ra ở nhiệt độ thường nên thường dùng S khử độc Hg)
Chú ý: Một số muối sunfua có màu đặc trưng: CuS, PbS, Ag2S (màu đen); MnS (màu hồng); CdS (màu vàng) → thường được dùng để nhận biết gốc sunfua.
- Muối sunfua được chia thành 3 loại:
+ Loại 1. Tan trong nước gồm Na2S, K2S, CaS và BaS, (NH4)2S.
+ Loại 2. Không tan trong nước nhưng tan trong axit mạnh gồm FeS, ZnS, ...
+ Loại 3. Không tan trong nước và không tan trong axit gồm CuS, PbS, HgS, Ag2S, ...
6.2. Lưu huỳnh có tính khử
Khi lưu huỳnh phản ứng với phi kim hoạt động mạnh hơn, số oxi hóa của lưu huỳnh từ 0 tăng lên +4 hoặc +6.
S → S+4 + 4e
S → S+6 + 6e
-
Tác dụng với phi kim
S thể hiện tính khử khi tác dụng với 1 số phi kim và 1 số hợp chất có tính oxi hóa.
Tác dụng với oxi:
S + O2 SO2
S + F2 SF6
-
Tác dụng với các chất có tính oxi hóa mạnh (H2SO4, HNO3,...)
S + H2SO4 đặc 3SO2 + 2H2O
S + 4HNO3 đặc 2H2O + 4NO2 + SO2
7. Ứng dụng của S
Lưu huỳnh được sử dụng trong nhiều sản phẩm công nghiệp, ví dụ như: Ắc quy, bột giặt, lưu hóa cao su, thuốc diệt nấm và các phân bón photphat. Cụ thể, được lưu huỳnh được sử dụng để tạo nên độ trắng của giấy, làm chất bảo quản trong rượu vang và làm khô hoa quả. Do bản chất dễ cháy, lưu huỳnh còn được ứng dụng trong sản xuất các loại diêm, thuốc súng, thuốc nổ cũng như pháo hoa…
8. Tính chất hóa học của H2SO4
8.1. H2SO4 loãng
Axit sunfuric là một axit mạnh, hóa chất này có đầy đủ các tính chất hóa học chung của axit như:
- Axit sunfuric H2SO4 làm chuyển màu quỳ tím thành đỏ.
- Tác dụng với kim loại đứng trước H (trừ Pb) tạo thành muối sunfat.
Fe + H2SO4 → FeSO4 + H2
- Tác dụng với oxit bazo tạo thành muối mới (trong đó kim loại giữ nguyên hóa trị) và nước .
FeO + H2SO4 → FeSO4 + H2O
- Axit sunfuric tác dụng với bazo tạo thành muối mới và nước.
H2SO4 + NaOH → NaHSO4 + H2O
H2SO4 + 2NaOH → Na2SO4 + 2H2O
- H2SO4 tác dụng với muối tạo thành muối mới (trong đó kim loại vẫn giữ nguyên hóa trị) và axit mới.
Na2CO3 + H2SO4 → Na2SO4 + H2O + CO2
H2SO4 + 2KHCO3 → K2SO4 + 2H2O + 2CO2
8.2. H2SO4 đặc
Axit sunfuric đặc có tính axit mạnh, oxi hóa mạnh với tính chất hóa học nổi bật như:
- Tác dụng với kim loại: Khi cho mảnh Cu vào trong H2SO4 tạo ra dung dịch có màu xanh và có khí bay ra với mùi sốc.
Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O
- Tác dụng với phi kim tạo thành oxit phi kim + H2O + SO2.
C + 2H2SO4 → CO2 + 2H2O + 2SO2 (nhiệt độ)
2P + 5H2SO4 → 2H3PO4 + 5SO2 + 2H2O
- Tác dụng với các chất khử khác.
2FeO + 4H2SO4 → Fe2(SO4)3 + SO2 + 4H2O
- H2SO4 còn có tính háo nước đặc trưng như đưa H2SO4 vào cốc đựng đường, sau phản ứng đường sẽ bị chuyển sang màu đen và phun trào với phương trình hóa học như sau.
C12H22O11 + H2SO4 → 12C + H2SO4.11H2O
9. Bài tập vận dụng
Câu 1. Hơi thủy ngân rất độc, do đó nếu khi ta vô tình đánh rơi vỡ nhiệt kế thì chất bột được dùng để rắc lên thủy ngân rồi gom lại là:
A. Bột lưu huỳnh
B. Cát
C. Muối ăn
D. Vôi bột
Lời giải:
Đáp án: A
Giải thích:
Thủy ngân tác dụng với lưu huỳnh ngay tại điều kiện thường:
Hg + S → HgS ↓
Do đó khi làm vỡ nhiệt kế thuỷ ngân thì chất bột được dùng để rắc lên thuỷ ngân rồi gom lại là lưu huỳnh.
Câu 2. Trong các phương trình dưới đây, phương trình nào S vừa đóng vai trò là chất khử vừa đóng vai trò là chất oxi hóa?
A. 4S + 6NaOH (đặc) 2Na2S + Na2S2O3 +3H2O
B. S + 3F2 SF6
C. S + 6HNO3 (đặc) H2SO4 + 6NO2 + 2H2O
D. S + 2Na Na2S
Lời giải:
Đáp án: A
Câu 3. Lưu huỳnh có thể tồn tại ở những trạng thái số oxi hoá nào?
A. -2; +4; +5; +6
B. -3; +2; +4; +6.
C. -2; 0; +4; +6
D. +1 ; 0; +4; +6
Lời giải:
Đáp án: C
Câu 4. Chất nào dưới đây được dùng để điều chế SO2 trong phòng thí nghiệm là
A. Na2SO3 và HCl
B. FeS2 và O2
C. S và O2
D. ZnS và O2
Lời giải:
Đáp án: A
Giải thích:
Na2SO3 + 2HCl → 2NaCl + SO2↑ + H2O
Câu 5. Kim loại nào dưới đây không phản ứng với H2SO4 đặc nguội?
A. Al
B. Cu
C. Zn
D. Ag
Lời giải:
Đáp án: A
Câu 6. Số hiệu nguyên tử của lưu huỳnh là 16. Cho biết vị trí của lưu huỳnh trong bảng tuần hoàn các nguyên tố hóa học?
A. Chu kì 3, nhóm VIA.
B. Chu kì 5, nhóm VIA.
C. chu kì 5, nhóm IVA.
D. chu kì 3, nhóm IVA.
Lời giải:
Đáp án: A
Giải thích:
Cấu hình electron nguyên tử S là: 1s22s22p63s23p4.
→ Lưu huỳnh ở chu kỳ 3 (do có 3 lớp electron); nhóm VIA (do có 6 electron hóa trị, nguyên tố p).
Câu 7. Chúng ta đều biết hơi thủy ngân rất độc, vậy trong trường hợp ta làm vỡ nhiệt kế thủy ngân, chúng ta dùng chất gì rắc lên thủy ngân và gom lại?
A. Bột than.
B. Cát mịn.
C. muối hạt.
D. Lưu huỳnh.
Lời giải:
Đáp án: D
Giải thích:
Giải thích: Ta có phương trình phản ứng:
S + Hg → HgS
Câu 8. Tính chất vật lí nào sau đây không phải là tính chất vật lí đặc trưng của lưu huỳnh?
A. chất rắn màu vàng.
B. không tan trong nước.
C. có nhiệt độ nóng chảy thấp hơn nhiệt độ sôi của nước.
D. tan nhiều trong benzen.
Lời giải:
Đáp án: C
Giải thích:
Giải thích: Lưu huỳnh tà phương nóng chảy ở 113oC, lưu huỳnh đơn tà nóng chảy ở 119oC.
→ Nhiệt độ nóng chảy của lưu huỳnh cao hơn nhiệt độ sôi của nước.
Câu 9. Dãy chất nào trong các dãy sau đây gồm các chất đều thể hiện tính oxi hóa khi phản ứng với SO2?
A. H2S, O2, nước brom
B. O2, nước brom, dung dịch KMnO4
C. Dung dịch NaOH, O2, dung dịch KMnO4
D. Dung dịch BaCl2, CaO, nước brom
Lời giải:
Đáp án: B
Giải thích:
Dãy chất đều thể hiện tính oxi hóa khi phản ứng với SO2 là:
O2 + 2SO2 → 2SO3
Br2 + H2O + SO2 → 2HBr + H2SO4
2KMnO4 + 2H2O + 5SO2 → K2SO4 + 2MnSO4 + 2H2SO4
Câu 10. Phát biểu nào sau đây sai?
A. Ở nhiệt độ thường, H2S là chất khí không màu, có mùi trứng thối, rất độc.
B. Ở nhiệt độ thường, SO2 là chất khí không màu, mùi hắc, tan nhiều trong nước.
C. Ở nhiệt độ thường, SO3 là chất khí không màu, tan vô hạn trong nước.
D. Trong công nghiệp, SO3 là chất khí không màu, tan vô hạn trong nước.
Lời giải:
Đáp án: C
Câu 11. Đun nóng 20 gam một hỗn hợp X gồm Fe và S trong điều kiện không có không khí thu được hỗn hợp rắn A. Hòa tan hỗn hợp rắn A vào dung dịch HCl thu được 6,72 lít (đktc) hỗn hợp khí Y. Thành phần phần trăm khối lượng Fe trong X là
A. 28%
B. 56%
C. 42%
D. 84%
Lời giải:
Đáp án: D
Giải thích:
Fe + S FeS
FeS + 2HCl → FeCl2 + H2S;
Fe + 2HCl → FeCl2 + H2
nFe(bđ) = nFeS + nFe(dư) = nH2S + nH2 = 6,72/22,4 = 0,3 (mol)
%mFe = 0,3.56/20.100% = 84%
Câu 12. Đốt cháy hoàn toàn m gam FeS2 bằng một lượng O2 vừa đủ, thu được khí X. Hấp thị hết X vào 2 lít dung dịch chứa Ba(OH)2 0,1M, thu được dung dịch Y và 21,7 gam kết tủa. Cho Y vào dung dịch NaOH, thấy xuất hiện thêm kết tủa. Giá trị của m là
A. 23,2
B. 12,6
C. 18,0
D. 24,0
Lời giải:
Đáp án: C
Giải thích:
nBa(OH)2= 0,1.2 = 0,2 (mol); nBaSO3 = 21,7/217 = 0,1 (mol)
nBaSO3= 2nBa(OH)2 - nSO2 ⇒ nSO2 = 2.0,2 – 0,1 = 0,3 (mol)
2nFeS2= 2nSO2 ⇒ nFeS2 = 0,15 (mol) ⇒ mFeS2= 0,15.120 = 18 (gam)
Câu 13. Khi nhỏ từ từ H2SO4đậm đặc vào đường chứa trong cốc hiện tượng quan sát được là:
A. Sủi bọt khí, đường không tan.
B. Màu trắng của đường mất dần, không sủi bọt.
C. Màu đen xuất hiện và có bọt khí sinh ra.
D. Màu đen xuất hiện, không có bọt khí sinh ra.
Lời giải:
Đáp án: C
Giải thích:
H2SO4 đặc có tính háo nước sẽ than hóa đường saccarozo (màu đen xuất hiện): C12H22O11 → 12C + 11H2O
Sau đó: C + 2H2SO4 → 2SO2 + CO2 + 2H2O (Có khí CO2, SO2 thoát ra)
Câu 14. Nung nóng 13,1 gam một hỗn hợp gồm Mg, Zn, Al trong không khí đến phản ứng hoàn toàn thu được 20,3 gam hỗn hợp gồm MgO, ZnO, Al2O3 Hoà tan 20,3 gam hỗn hợp oxit trên cần dùng V lít dung dịch HCl 0,4M. Tính khối lượng muối clorua tạo ra.
A. 45,05g
B. 46,5g
C. 43,36g
D. 45,85g
Lời giải:
Đáp án: A
Giải thích:
Ta có sơ đồ chuyển hoá :
Mg, Zn, Al → O2 MgO, ZnO, Al2O3
MgO + 2HCl → MgCl2 + H2O
ZnO + 2HCl → ZnCl2 + H2O
Al2O3 + 6HCl → 2AlCl3 + 3H2O
MgO, ZnO, Al2O3 → HCl, MgCl2, ZnCl2, AlCl3
Bảo toàn khối lượng: moxit + mHCl = mmuối + mH2O
⇒ 20,3 + 0,9.36,5 = mmuối + 0,45.18
⇒ mmuối = 45,05 g
Câu 15. Cho m gam FeO tác dụng hết với H2SO4 đặc nóng (dư), thoát ra 0,112 lít (ở đktc) khí SO2 (là sản phẩm khử duy nhất). Giá trị của m là
A. 7,2 g
B. 3,6 g
C. 0,72 g
D. 0,36 g
Lời giải:
Đáp án: C
Giải thích:
Phương trình phản ứng
2FeO + 4H2SO4 → Fe2(SO4)3 + SO2 + 4H2O
0,01 0,005 mol
mFeO = 0,01.72 = 0,72 gam
Câu 16. Cho 5,5 gam hỗn hợp bột sắt và bột nhôm tác dụng với bột lưu huỳnh trong điều kiện không có không khí) thấy có 6,4 gam lưu huỳnh tham gia phản ứng. Khối lượng sắt có trong 5,5 gam hỗn hợp đầu là
A. 5,6 gam.
B. 11,2 gam.
C. 2,8 gam.
D. 8,4 gam.
Lời giải:
Đáp án: C
Giải thích:
nS = 6,4/32 = 0,2 (mol)
⇒ mhh= mFe + mAl
Bảo toàn electron: 2nFe+ 3nAl= 2nS
⇒ 56nFe + 27nAl = 5,5
2nFe + 3nAl = 2.0,2
⇒ nFe= 0,05
nAl= 0,1) ⇒ mFe = 0,05.56 = 2,8 (gam)
Câu 17. Cho 41,6 gam hỗn hợp FeS và FeS2 vào bình kín chứa không khí dư. Nung nóng bình để phản ứng xảy ra hoàn toàn. Sau phản ứng ta thấy số mol khí trong bình giảm 0,3 mol. Thành phần % theo khối lượng của hỗn hợp FeS và FeS2 là:
A. 42,3 và 57,7%
B. 50% và 50%
C. 42,3% và 59,4%
D. 30% và 70%
Lời giải:
Đáp án: A
Giải thích:
Các phản ứng xảy ra:
4FeS + 7O2 → 2Fe2O3 + 4SO2
4x → 7x → 4x
4FeS2 + 11O2 → 2Fe2O3 + 8SO2
4y → 11y → 8y
Số mol khí giảm = số mol khí pư – số mol khí tạo thành
→ 7x + 11y – (4x + 8y) = 0,3
↔ 3x + 3y = 0,3 (1)
Theo đề bài: 88 × 4x + 120 × 4y = 41,6 (2)
→ x = y = 0,05
%FeS = (88 × 4x)/41,6 × 100% = 42,3%
Câu 18. Nung nóng m gam PbS ngoài không khí sau một thời gian, thu được hỗn hợp rắn (có chứa một oxit) nặng 0,95m gam. Phần trăm khối lượng PbS đã bị đốt cháy là
A. 74,69%
B. 95,00%
C. 25,31%
D. 64,68%
Lời giải:
Đáp án: A
Giải thích:
Áp dụng định luật bảo toàn khối lượng ta có:
mO = m – 0,95m = 0,05m (g) → nO = 3,125.10-3m (mol)
Ta có: nPbS phản ứng = nPbO = nO= 3,125.10-3m (mol)
→ %PbS (đã bị đốt cháy) = (3,125.10-3 m.239.100% )/m = 74,69%
Câu 19. Nhận định nào sau đây phản ánh đúng tính chất hóa học của lưu huỳnh?
A. Lưu huỳnh chỉ có tính oxi hóa.
B. Lưu huỳnh chỉ có tính khử.
C. Lưu huỳnh vừa có tính khử vừa có tính oxi hóa.
D. Lưu huỳnh không có tính oxi hóa và không có tính khử.
Lời giải:
Đáp án: C
Giải thích:
C. Lưu huỳnh vừa có tính khử vừa có tính oxi hóa.
Câu 20. Trong gia đình, chúng ta thường có sẵn một chiếc nhiệt kế thủy ngân, chẳng may nhiệt kế bị vỡ, thủy ngân bắn ra ngoài, ta phải dùng biện pháp nào sau đây để thu gom thủy ngân có hiệu quả nhất?
A. Dùng chổi quét nhiều lần, sau đó gom lại bỏ vào thùng rác.
B. Dùng giẻ tẩm dung dịch giấm ăn, lau sạch nơi nhiệt kế vỡ.
C. Lấy bột lưu huỳnh rắc lên chỗ nhiệt kế vỡ, sau đó dùng chổi quét gom lại bỏ vào thùng rác.
D. Lấy muối ăn rắc lên chỗ nhiệt kế vỡ, sau đó dùng chổi quét gom lại bỏ vào thùng rác.
Lời giải:
Đáp án: C
Câu 21. Tính chất vật lí nào sau đây không phải của lưu huỳnh
A. chất rắn màu vàng, giòn
B. không tan trong nước
C. có tnc thấp hơn ts của nước
D. tan nhiều trong benzen, ancol etylic
Lời giải:
Đáp án: C
Giải thích:
Nhiệt độ nóng chảy của S là 115,21oC lớn hơn nhiệt độ sôi của nước
Câu 22. Chỉ ra câu trả lời không đúng về khả năng phản ứng của S?
A. S vừa có tính oxi hoá vừa có tính khử.
B. Hg phản ứng với S ngay nhiệt độ thường.
C. Ở nhiệt độ thích hợp, S tác dụng với hầu hết các phi kim và thể hiện tính oxi hóa.
D. Ở nhiệt độ cao, S tác dụng với nhiều kim loại và thể hiện tính oxi hoá.
Lời giải:
Đáp án: C
Giải thích:
Câu không đúng là: Ở nhiệt độ thích hợp, S tác dụng với hầu hết các phi kim và thể hiện tính oxi hóa.
Vì S phản ứng với oxi thể hiện tính khử: S + O2 → SO2
Câu 23. Ở điều kiện thường, kim loại nào sau đây phản ứng với bột lưu huỳnh?
A. Fe
B. Hg
C. Cr
D. Cu
Lời giải:
Đáp án: B
Giải thích:
Hg là kim loại duy nhất phản ứng với S ở nhiệt độ thường
Hg + S → HgS
Câu 24. Trong các phản ứng sau đây, ở phản ứng nào axit H2SO4 là axit loãng?
A. 2H2SO4 + C → 2SO2 + CO2 + 2H2O.
B. H2SO4 + 2Na → Na2SO4 + H2
C. 2H2SO4+ S → 3SO2 + 2H2O.
D. 6H2SO4 + 2Fe → Fe2(SO4)3 + 3SO2 + 6H2O
Lời giải:
Đáp án: B
Câu 25. Nhận định nào sau đây phản ánh đúng tính chất hóa học của lưu huỳnh ?
A. Lưu huỳnh chỉ có tính oxi hóa.
B. Lưu huỳnh chỉ có tính khử.
C. Lưu huỳnh vừa có tính khử vừa có tính oxi hóa.
D. Lưu huỳnh không có tính oxi hóa và không có tính khử.
Lời giải:
Đáp án: C
Câu 26. Dãy gồm các chất đều tác dụng với lưu huỳnh (trong điều kiện phản ứng thích hợp) là:
A. Zn, H2, O2, F2.
B. H2, Pt, Cl2, KClO3.
C. Hg, O2, F2, HCl.
D. Na, He, Br2, H2SO4 loãng
Lời giải:
Đáp án: A
Giải thích:
Dãy B: S không tác dụng với Pt.
Dãy C: S không tác dụng với HCl
Dãy D: S không tác dụng với He, H2SO4 loãng.
Lưu huỳnh tác dụng với dãy chất: Zn, H2, O2, F2.
Xem thêm các phương trình phản ứng hóa học khác:
Xem thêm các chương trình khác:
- Các dạng bài tập Tiếng Anh thông dụng nhất
- 3000 câu hỏi ôn tập môn Tiếng Anh có đáp án
- Toàn bộ kiến thức về cụm động từ | Định nghĩa và cách dùng
- 500 đoạn văn Tiếng Anh thông dụng nhất và cách làm
- 1000 câu hỏi ôn tập môn Công nghệ có đáp án
- 1000 câu hỏi ôn tập Giáo dục công dân
- 15000 câu hỏi ôn tập môn Toán có đáp án
- Wiki Toán | Khái niệm, định lí, tính chất, dạng bài, công thức
- Tuyển tập đề thi + chuyên đề ôn thi Toán Kangaroo các cấp độ (có đáp án 2024)
- 3000 câu hỏi ôn tập môn Vật lí có đáp án
- Tổng hợp Dạng bài - Công thức môn Vật lí
- 2000 câu hỏi ôn tập môn Tin học có đáp án
- 3000 câu hỏi ôn tập môn Lịch sử có đáp án
- 3000 câu hỏi ôn tập môn Địa lí có đáp án
- 2000 câu hỏi ôn tập môn Sinh học có đáp án
- Tổng hợp Dạng bài - Công thức môn Sinh học
- Tổng hợp về các tác giả văn học
- 3000 câu hỏi ôn tập môn Ngữ văn có đáp án
- Tổng hợp kiến thức Ngữ Văn
- Tuyển tập truyện dân gian, truyền thuyết, cổ tích,... Việt Nam
- Tổng hợp các đề đọc - hiểu có đáp án chi tiết
- Trò chơi Powerpoint | Game Powerpoint
- Tổng hợp bài thu hoạch BDTX Giáo viên mầm non (2025) theo Thông tư 12
- Tổng hợp bài thu hoạch BDTX Giáo viên tiểu học (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THCS (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THPT (2025)
