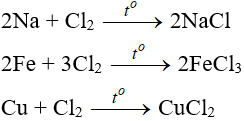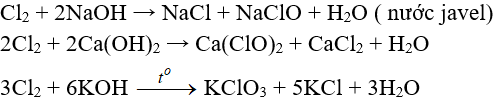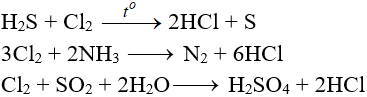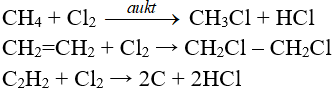Cl2 + NaOH → NaCl + NaClO + H2O | NaOH ra NaCl
Cl2 + NaOH → NaCl + NaClO + H2O là phản ứng oxi hóa khử. Bài viết này cung cấp đầy đủ thông tin về phương trình hóa học đã được cân bằng, điều kiện các chất tham gia phản ứng, hiện tượng (nếu có), ... Mời các bạn đón xem:
Phản ứng Cl2 + NaOH → NaCl + NaClO + H2O
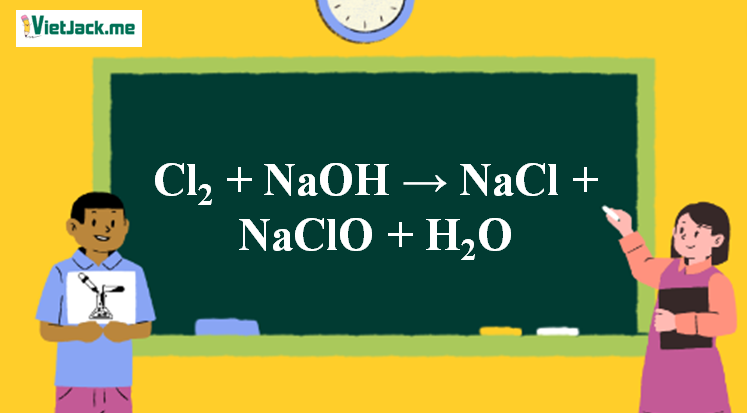
1. Phương trình Cl2 ra nước Gia ven
Cl2 + 2NaOH → NaCl + NaClO + H2O
2. Điều kiện phản ứng Clo tác dụng với NaOH
Điện phân dung dịch natri clorua NaCl có màng ngăn bằng xốp với điện cực dương bằng than chì và điện cực âm làm bằng sắt.
3. Clo tác dụng với NaOH có hiện tượng gì
Dẫn khí clo vào cốc đựng dung dịch NaOH loãng, nhúng một mẩu giấy quỳ tím vào dung dịch thu được dung dịch nước Giaven. Giấy quỳ tím bị mất màu.
4. Tính chất hoá học của Clo
4.1. Tác dụng với kim loại
Đa số kim loại và có to để khơi màu phản ứng tạo muối clorua (có hoá trị cao nhất )
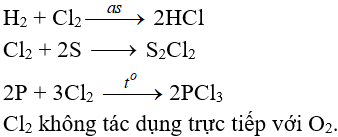
4.2. Tác dụng với phi kim
(cần có nhiệt độ hoặc có ánh sáng)
4.3. Tác dụng với nước và dung dịch kiềm
Cl2 tham gia phản ứng với vai trò vừa là chất ôxi hóa, vừa là chất khử.
a. Tác dụng với nuớc
Khi hoà tan vào nước, một phần Clo tác dụng (Thuận nghịch)
Cl20 + H2O → HCl + HClO (Axit hipoclorơ)
Axit hipoclorơ có tính oxy hoá mạnh, nó phá hửy các màu vì thế nước clo hay clo ẩm có tính tẩy màu do.
b. Tác dụng với dung dịch bazơ
4.4. Tác dụng với muối của các halogen khác
Cl2 + 2NaBr → 2NaCl + Br2
Cl2 + 2FeCl2 → 2FeCl3
3Cl2 + 6FeSO4 → 2Fe2(SO4)3 + 2FeCl3
Cl2 + 2KI → 2KCl + I2
4.5. Tác dụng với chất khử khác
4.6. Phản ứng thế, phản ứng cộng, phản ứng phân huỷ với một số hợp chất hữu cơ
4.7. Ứng dụng
Ứng dụng chủ yếu nhất của clo là dùng để điều chế nhựa PVC cũng như các chất dẻo hay cao su. Ngoài ra, với tính oxi hóa và tính khử, CLORAMIN còn được dùng để khử trùng nước sinh hoạt. Clo còn là một trong những thành phần để điều chế nước javen tẩy trắng quần áo, vải sợi…
5. Mở rộng thêm kiến thức về nước Giaven
5.1. Nước Javen là gì?
Nước Giaven hay Javen là một hợp chất hỗn hợp được tạo thành bởi hai muối NaCl và NaClO khi sục khí Clo dư vào Natri Hydroxit
Đặc tính của nước Javen
Nước Javen là một hợp chất có tính oxy hóa mạnh – chất tẩy rửa cực mạnh.
NaClO là thành phần chính của Nước Javen mà NaClO là một axit có tính oxi hóa rất mạnh. Trong hợp chất, Cl có số oxi hóa +1, do vậy nó có khả năng oxi hóa mạnh các chất để trở về số oxi hóa thấp hơn.
Các hợp chất phức hữu cơ dưới dạng các vết mực, vết màu dính trên quần áo, vật liệu sẽ bị tính oxi hóa mạnh của phân tử NaClO làm phá vỡ nên sẽ nhanh chóng tẩy được những vết bẩn rất hữu hiệu.
Nước Javen là hỗn hợp có mùi xốc khi sử dụng.
Trong môi trường axit, NaClO phản ứng theo phương trình
NaClO + 2HCl → NaCl + Cl2 + H2O
Khí Cl2 tạo thành có mùi xốc, khi ảnh hưởng xấu đến sức khỏe con người khi hít phải. Nên chúng ta phải cẩn thận khi sử dụng hóa chất này.
5.2. Điều chế nước javen trong phòng thí nghiệm
Cách 1: Điều chế từ Cl2 và NaOH
Trong phòng thí nghiệm, nước javen được điều chế trực tiếp bằng Cl2 và dung dịch NaOH. Chúng ta tiến hành cho khí Cl2 đi qua dung dịch NaOH ở nhiệt độ thường. Kết quả của phản ứng sẽ tạo ra hỗn hợp dung dịch NaCl và nước giaven.
Phương trình phản ứng như sau:
Cl2 + 2NaOH → NaCl + NaClO + H2O
Cách 2: Điều chế từ MnO2 và HCl
Ở phương pháp này, người ta sẽ tiến hành cho hóa chất MnO2 phản ứng với axit HCl để tạo ra khí clo. Sau đó tiếp tục sục khí Cl2 đi qua dung dịch NaOH sẽ thu được hóa chất NaClO (nước gia-ven).
Phương trình phản ứng:
4HCl + MnO2 → Cl2 + 2H2O + MnCl2
Cl2 + 2NaOH → NaCl + NaClO + H2O
Trong công nghiệp
Trong công nghiệp, điều chế nước Javen từ NaCl là phương pháp được sử dụng phổ biến nhất. Dung dịch muối ăn sẽ được đem đi điện phân có màng ngăn để tạo ra NaOH, khí Hydro và Clo. Sau đó, Clo tiếp tục phản ứng với dung dịch NaOH sẽ tạo ra hỗn hợp nước gia-ven.
6. Tính chất hoá học của NaOH
NaOH là một bazơ mạnh nó sẽ làm quỳ tím chuyển màu xanh, còn dung dịch phenolphtalein thành màu hồng. Một số phản ứng đặc trưng của Natri Hidroxit được liệt kê ngay dưới đây.
Phản ứng với axit tạo thành muối + nước:
NaOHdd + HCldd→ NaCldd + H2O
Phản ứng với oxit axit: SO2, CO2…
2NaOH + SO2→ Na2SO3 + H2O
NaOH + SO2→ NaHSO3
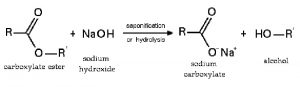
Phản ứng với axit hữu cơ tạo thành muối và thủy phân este, peptit:
Phản ứng với muối tạo bazo mới + muối mới (điều kiện: sau phản ứng phải tạo thành chất kết tủa hoặc bay hơi):
2NaOH + CuCl2→ 2NaCl + Cu(OH)2↓
Tác dụng với kim loại lưỡng tính:
2NaOH + 2Al + 2H2O→ 2NaAlO2 + 3H2↑
2NaOH + Zn → Na2ZnO2 + H2↑
Tác dụng với hợp chất lưỡng tính:
NaOH + Al(OH)3 → NaAl(OH)4
2NaOH + Al2O3 → 2NaAlO2 + H2O
7. Bài tập vận dụng liên quan
Câu 1. Nước Gia-ven là hỗn hợp các chất nào sau đây?
A. HCl, HClO, H2O
B. NaCl, NaClO4, H2O
C. NaCl, NaClO, H2O
D. NaCl, NaClO3, H2O
Lời giải:
Câu 2. Vì sao nước clo có tính tẩy màu
A. vì khi dẫn khí clo vào nước không xảy ra phản ứng hoá học
B. Vì clo tác dụng với nước tạo nên axit HCl có tính tẩy màu
C. Vì clo hấp phụ được màu
D. Vì clo tác dụng nước tạo nên axit HClO có tính tẩy màu
Lời giải:
Câu 3. Thành phần của nước clo có chứa những chất nào dưới đây
A. H2O, Cl2, HClO3
B. HCl, HClO
C. Cl2, HCl, HClO2
D. Cl2, HCl, HClO
Lời giải:
Câu 4. Thực hiện thí nghiệm cho Cl2 tác dụng với dung dịch NaOH ở nhiệt độ thường, trong phản ứng dưới đây Cl2 đóng vai trò là
2NaOH + Cl2 → NaCl + NaClO + H2O
A. chất nhường proton.
B. chất nhận proton.
C. chất nhường electron cho NaOH.
D. vừa là chất khử, vừa là chất oxi hóa.
Lời giải:
Cl2 + 2NaOH → NaCl + NaClO + H2O. Trong phản ứng này vừa là chất khử, vừa là chất oxi hoá
Khi cho Cl2 tác dụng với dung dịch NaOH ở nhiệt độ thường trong phàn ứng này Cl2 đóng vai trò vừa là chất khử, vừa là chất oxi hoá
Câu 5. Trong tự nhiên, clo tồn tại chủ yếu ở dạng nào
A. muối clorua
B. muối natri clorat
C. Axit clohidric
D. Đơn chất
Lời giải:
Câu 6. Để thu được khí clo trong phòng thí nghiệm, người ta thu bằng cách
A. dẫn khí clo vào một bình úp ngược sẵn
B. dẫn khí clo vào một bình được đậy bằng nút cao su có ống dẫn khí
C. dẫn khí clo vào một bình nút bằng bông được tẩm dung dịch NaOH đặc
D. thu clo bằng cách dời chỗ của nước
Lời giải:
Câu 7. Khí clo có các tính chất nào sau đây?
A. Khí clo có màu vàng lục, tan ít trong nước, không độc
B. Khí clo không màu, mùi sốc, tan ít trong nước, rất độc
C. Khí clo có màu vàng lục, mùi sốc, tan ít trong nước, rất độc.
D. Màu vàng lục, mùi hắc, tan nhiều trong nước, rất độc
Lời giải:
Clo là một phi kim và cụ thể là một nguyên tố thuộc nhóm halogen. Ở điều kiện thường, clo ở trạng thái khí. Chúng có màu vàng lục và mùi rất hắc. Đây là một halogen tương đối độc, giống với brom.
Clo ở trạng thái phân tử có khối lượng là 71, do đó, nó sẽ nặng hơn không khí gần 2,5 lần. Thông thường, clo có thể tan được trong nước. Tuy nhiên, chúng thường tan mạnh hơn trong các dung môi hữu cơ.
Câu 8. Trong công nghiệp khí clo có thể được sản xuất bằng cách nào sau đây
A. điện phân dung dịch NaCl có màng ngăn xốp
B. điện phân dung dịch NaCl không có màng ngăn xốp
C. dùng khí Flo đẩy Cl2 khỏi dung dịch muối NaCl
D. nhiệt phân muối NH4Cl
Lời giải:
Trong công nghiệp, người ta điện phân dung dịch bão hòa muối ăn trong nước để sản xuất xút NaOH, đồng thời thu được khí clo và hidro (clo là sản phẩm phụ của quá trình sản xuất xút). Thùng điện phân có màng ngăn cách 2 điện cực để khí clo không tiếp xúc với dung dịch NaOH.
2NaCl + 2H2O → 2NaOH + H2 + Cl2.
Câu 9. Cho 100 gam dung dich HCl 36,5% vào bình đựng 15,4 gam MnO2, đun nhẹ. Thể tích khí clo (Đktc) thoát ra lớn nhất bằng
A. 2,24 lít
B. 3,36 lít
C. 5,6 lít
D. 4,48 lít
Lời giải:
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O
0,2 0,8 0,2
Ta có: mHCl = 36,5 gam => nHCl = 1,0 mol; nMnO2 = 0,2 mol
nHCl → 4nMnO2 => HCl dư
nCl2 = nMnO2 = 0,2 mol => VCl2 = 0,1.22,4 = 4,48 lít
Câu 10. Tính chất nào sau đây không phải là của khí Cl2?
A. Tan hoàn toàn trong H2O tạo dung dịch Clo.
B. Có màu vàng lục.
C. Có tính tẩy trắng khi ẩm.
D. Có mùi hắc, rất độc, sát trùng H2O.
Lời giải:
Xem thêm các phương trình hóa học khác:
Cl2 + Ca(OH)2 → Ca(OCl)2 + CaCl2 + H2O
Cl2 + KOH đặc nóng → KCl + KClO3 + H2O
Xem thêm các chương trình khác:
- Các dạng bài tập Tiếng Anh thông dụng nhất
- 3000 câu hỏi ôn tập môn Tiếng Anh có đáp án
- Toàn bộ kiến thức về cụm động từ | Định nghĩa và cách dùng
- 500 đoạn văn Tiếng Anh thông dụng nhất và cách làm
- 1000 câu hỏi ôn tập môn Công nghệ có đáp án
- 1000 câu hỏi ôn tập Giáo dục công dân
- 15000 câu hỏi ôn tập môn Toán có đáp án
- Wiki Toán | Khái niệm, định lí, tính chất, dạng bài, công thức
- Tuyển tập đề thi + chuyên đề ôn thi Toán Kangaroo các cấp độ (có đáp án 2024)
- 3000 câu hỏi ôn tập môn Vật lí có đáp án
- Tổng hợp Dạng bài - Công thức môn Vật lí
- 2000 câu hỏi ôn tập môn Tin học có đáp án
- 3000 câu hỏi ôn tập môn Lịch sử có đáp án
- 3000 câu hỏi ôn tập môn Địa lí có đáp án
- 2000 câu hỏi ôn tập môn Sinh học có đáp án
- Tổng hợp Dạng bài - Công thức môn Sinh học
- Tổng hợp về các tác giả văn học
- 3000 câu hỏi ôn tập môn Ngữ văn có đáp án
- Tổng hợp kiến thức Ngữ Văn
- Tuyển tập truyện dân gian, truyền thuyết, cổ tích,... Việt Nam
- Trò chơi Powerpoint | Game Powerpoint
- Tổng hợp bài thu hoạch BDTX Giáo viên mầm non (2025) theo Thông tư 12
- Tổng hợp bài thu hoạch BDTX Giáo viên tiểu học (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THCS (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THPT (2025)