NaCl → Na + Cl2 | NaCl ra Na
NaCl → Na + Cl2 là phản phân huỷ. Bài viết này cung cấp đầy đủ thông tin về phương trình hóa học đã được cân bằng, điều kiện các chất tham gia phản ứng, hiện tượng (nếu có), ... Mời các bạn đón xem:
Phản ứng NaCl Na + Cl2
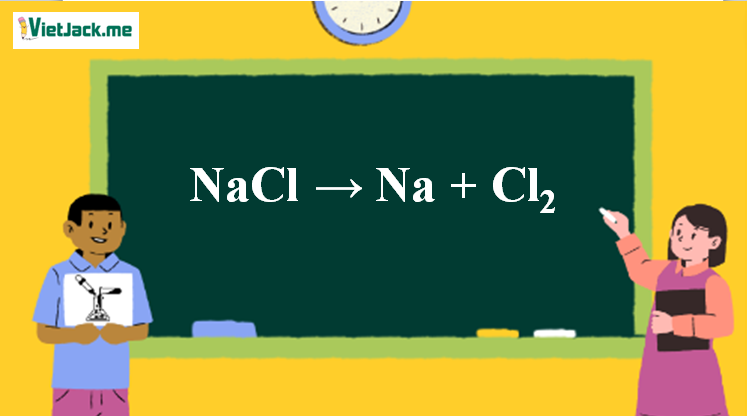
1. Phương trình điện phân NaCl nóng chảy
2NaCl 2Na + Cl2
2. Điều kiện điện phân nóng chảy NaCl
Điện phân nóng chảy NaCl.
Các phản ứng xảy ra ở điện cực:
Ở cực catot (cực âm) xảy ra sự khử ion Na+ thành Na: Na+ + 1e → Na
Ở cực anot (cực dương) xảy ra sự oxi hóa Cl- thành Cl2: 2Cl- → Cl2 + 2e
3. Tính chất của NaCl
3.1. Nguồn gốc của muối tinh khiết NaCl
Muối NaCl một phần xuất phát từ miệng núi lửa hoặc đá trên đáy biển. Tuy nhiên, phần lớn muối có nguồn gốc trên đất liền.
Nước ngọt từ những cơn mưa không ở dạng tinh khiết 100% → Nó hòa tan CO2 trong khí quyển trước khi rơi xuống đất
→ Nước mưa chảy trên mặt đất để tiếp cận đường thoát nước trong khu vực
→ Tính axit của nước mưa phá vỡ đá, thu giữ ion trong đá và mang chúng ra biển
→ Khoảng 90% các ion này là natri hoặc clo
→ Hai loại ion này kết hợp với nhau tạo ra muối.
3.2. Tính chất vật lý của muối tinh khiết
Muối NaCl là chất rắn kết tinh không màu hoặc màu trắng
Cấu trúc tinh thể: Mỗi nguyên tử có 6 nguyên tử cận kề tạo ra cấu trúc bát diện. Sự phân bổ này được gọi là khớp nối lập phương kín.
3.3. Tính chất hóa học của muối tinh khiết
NaCl là chất điện li mạnh, phân li hoàn toàn trong nước, tạo ra các ion âm và dương.
Natri Clorua là muối của bazo khá mạnh và axit mạnh nên nó mang tính trung tính → do đó tương đối trơ về mặt hóa học.
Muối là hợp chất ion do đó chúng cho thấy các phản ứng ion xảy ra nhanh chóng và thường tỏa nhiệt trong tự nhiên. Muối không trải qua quá trình đốt cháy nhưng điện phân muối sẽ giải phóng kim loại và phi kim loại như điện phân NaCl nóng chảy tạo thành khí clo và natri kim loại.
2NaCl → 2Na + Cl2
Phản ứng của muối với axit là phản ứng chuyển vị kép như natri clorua phản ứng với axit sunfuric tạo thành natri sunfat và hydro clorua.
2NaCl + H2SO4→ Na2SO4 + 2HCl
Tương tự dung dịch natri clorua phản ứng với dung dịch bạc nitrat và tạo thành bạc clorua.
NaCl + AgNO3 → NaNO3 + AgCl
4. Ứng dụng của NaCl
Trong nông nghiệp, chăn nuôi:
– Muối giúp cân bằng sinh lý trong cơ thể giúp gia súc, gia cầm phát triển khỏe mạnh, giảm bệnh tật.
– Giúp phân loại hạt giống theo trọng lượng
– Cung cấp thêm vi lượng khi trộn với các loại phân hữu cơ để tăng hiệu quả của phân bón.
Trong thực phẩm:
– Natri Clorua có tính hút ẩm, do đó được sử dụng để bảo quản thực phẩm, nó làm tăng áp suất thẩm thấu dẫn đến làm cho vi khuẩn bị mất nước và chết.
– Dùng muối để ướp thực phẩm sống như tôm, cá,…để không bị ươn, ôi trước khi thực phẩm được nấu.
– Khử mùi thực phẩm, giữ cho trái cây không bị thâm.
– Tăng hương vị, kiểm soát quá trình lên men của thực phẩm.
Trong y tế:
– Muối Natri Clorua dùng để sát trùng vết thương rất tốt.
– Dùng để trị cảm lạnh, pha huyết thanh, thuốc tiêu độc và một số loại thuốc khác để chữa bệnh cho con người.
– Cung cấp muối khoáng cho cơ thể thiếu nước.
– Muối có tác dụng khử độc, thanh lọc cơ thể, làm đẹp da, chữa viêm họng, làm trắng răng, chữa hôi miệng,…
Trong đời sống gia đình:
– Đuổi kiến
– Dập tắt lửa bùng cháy vì dầu mỡ
– Giữ nến khỏi chảy khi đốt
– Giữ cho hoa đã hái được tươi, hỗ trợ căm hoa giả
5. Bài tập vận dụng liên quan
Câu 1. Điện phân NaCl nóng chảy với điện cực trơ ở catôt thu được
A. Na
B. HCl
C. NaOH
D. Cl2
Lời giải
Đáp án: A
Câu 2. Điện phân NaCl nóng chảy với cường độ I = 1,93A trong thời gian 6 phút 40 giây thì thu được 0,1472 gam Na. Hiệu suất quá trình điện phân là
A. 90%.
B. 80%.
C. 100%.
D. 75%.
Lời giải
Đáp án: B
t = 400s → mNa thu được lí thuyết = = 0,184 gam
mà khối lượng Natri: mNa thực tế = 0,1472 gam
→ H = = 80%
Câu 3. Điện phân dung dịch NaCl điện cực trơ, không có màng ngăn, sản phấm thu được gồm những chất nào dưới đây.
A. H2, Cl2, NaOH
B. H2, Cl2, NaOH, nước Giaven
C. H2, Cl2, nước Giaven
D. H2, nước Giaven
Lời giải
Đáp án: D
Câu 4. Khi điện phân NaCl nóng chảy (điện cực trơ), tại catot xảy ra
A. sự khử ion Cl-.
B. sự oxi hóa ion Cl-.
C. sự oxi hóa ion Na+.
D. sự khử ion Na+.
Lời giải
Đáp án: D
Catot (-):
Na+ + 1e → Na quá trình nhận e quá trình khử ion Na+
Anot (+):
2Cl- → Cl2 + 2e quá trình nhường e quá trình oxi hóa Cl-
Câu 5. Nhận định nào đúng về quá trình xảy ra ở cực âm và cực dương khi điện phân dung dịch NaCl và điện phân NaCl nóng chảy?
A. Ở catot đều là quá trình khử ion Na+, ở anot đều là quá trình oxi hóa ion Cl-
B. Ở catot đều là quá trình khử nước, ở anot đều là quá trình oxi hóa ion Cl-
C. Ở catot, điện pân dung dịch NaCl là quá trình khử nước, điện phân NaCl nóng chảy là quá trình khử ion Na+, ở anot đều có quá trình oxi hóa ion Cl-
D. Ở catot, điện phân dung dịch NaCl là quá trình khử ion Na+, điện phân NaCl nóng chảy là quá trình khử nước. Ở anot đều là quá trình oxi hóa ion Cl-
Lời giải
Đáp án: C
Điện phân dung dịch NaCl:
2NaCl + 2H2O → 2NaOH + Cl2 + H2
Điện phân NaCl nóng chảy:
2NaCl → 2Na + Cl2
→ ở catot, điện phân dung dịch NaCl là quá trình khử nước, điện phân NaCl nỏng chảy là quá trình khử ion Na+, ở anot đều có quá trình oxi hóa ion Cl-
Câu 6. Trong quá trình điện phân dung dịch NaCl, ở cực âm xảy ra
A. Sự khử phân tử nước
B. Sự oxi hoá ion Na+
C. Sự oxi hoá phân tử nước
D. Sự khử ion Na+
Lời giải
Đáp án: A
Điện phân dung dịch NaCl:
Ở cực âm (catot): trên bề mặt của cực âm có các ion Na+ và phân tử H2O. Ở đây xảy ra sự khử các phân tử H2O: 2H2O + 2e → H2 + 2OH-.
Ở cực dương (anot): trên bề mặt của cực dương có các ion Cl- và phân tử H2O. Ở đây xảy ra sự oxi hóa các ion Cl-: 2Cl- → Cl2 + 2e
Câu 7. Nhận xét nào là đúng khi điện phân dung dịch NaCl có màng ngăn sau?
A. Ở catot xảy ra sự khử ion kim loại Natri.
B. Ở anot xảy ra sự oxi hóa H2O.
C. Ở anot sinh ra khí H2.
D. Ở catot xảy ra sự khử nước.
Lời giải
Đáp án: D
Do ion Na+ không bị điện phân trong dung dịch ⇒ tại catot chỉ xảy ra sự khử H2O.
Câu 8. Điện phân dung dịch NaCl có màng ngăn. Nhận xét nào sau đây là đúng?
A. Ở catot xảy ra sự khử ion kim loại Natri.
B. Ở anot xảy ra sự oxi hóa H2O.
C. Ở anot sinh ra khí H2.
D. Ở catot xảy ra sự khử nước.
Lời giải
Đáp án: D
Câu 9. Điện phân dung dịch NaCl điện cực trơ, không có vách ngăn. Sản phấm thu được gồm
A. H2, Cl2, NaOH
B. H2, Cl2, NaOH, nước Giaven
C. H2, Cl2, nước Giaven
D. H2, nước Giaven
Lời giải
Đáp án: D
Phương trình điện phân có màng ngăn: 2NaCl + 2H2O → 2NaOH + H2 + Cl2
Nếu không có màng ngăn thì: Cl2 + 2NaOH → NaCl + NaClO + H2O
phương trình điện phân: NaCl + H2O → NaClO + H2
Xem thêm các phương trình hóa học khác:
NaHCO3 + Ca(OH)2 → CaCO3 + NaOH + H2O
Xem thêm các chương trình khác:
- Các dạng bài tập Tiếng Anh thông dụng nhất
- 3000 câu hỏi ôn tập môn Tiếng Anh có đáp án
- Toàn bộ kiến thức về cụm động từ | Định nghĩa và cách dùng
- 500 đoạn văn Tiếng Anh thông dụng nhất và cách làm
- 1000 câu hỏi ôn tập môn Công nghệ có đáp án
- 1000 câu hỏi ôn tập Giáo dục công dân
- 15000 câu hỏi ôn tập môn Toán có đáp án
- Wiki Toán | Khái niệm, định lí, tính chất, dạng bài, công thức
- Tuyển tập đề thi + chuyên đề ôn thi Toán Kangaroo các cấp độ (có đáp án 2024)
- 3000 câu hỏi ôn tập môn Vật lí có đáp án
- Tổng hợp Dạng bài - Công thức môn Vật lí
- 2000 câu hỏi ôn tập môn Tin học có đáp án
- 3000 câu hỏi ôn tập môn Lịch sử có đáp án
- 3000 câu hỏi ôn tập môn Địa lí có đáp án
- 2000 câu hỏi ôn tập môn Sinh học có đáp án
- Tổng hợp Dạng bài - Công thức môn Sinh học
- Tổng hợp về các tác giả văn học
- 3000 câu hỏi ôn tập môn Ngữ văn có đáp án
- Tổng hợp kiến thức Ngữ Văn
- Trò chơi Powerpoint | Game Powerpoint
- Tổng hợp bài thu hoạch BDTX Giáo viên mầm non (2024) theo Thông tư 12
- Tổng hợp bài thu hoạch BDTX Giáo viên tiểu học (2024)
- Tổng hợp bài thu hoạch BDTX Giáo viên THCS (2024)
- Tổng hợp bài thu hoạch BDTX Giáo viên THPT (2024)
