KMnO4 + HCl → KCl + MnCl2 + Cl2 + H2O | KMnO4 ra KCl | KMnO4 ra Cl2
KMnO4 + HCl → KCl + MnCl2 + Cl2 + H2O là phản ứng oxi hóa khử. Bài viết này cung cấp đầy đủ thông tin về phương trình hóa học đã được cân bằng, điều kiện các chất tham gia phản ứng, hiện tượng (nếu có), ... Mời các bạn đón xem:
Phản ứng KMnO4 + HCl → KCl + MnCl2 + Cl2 + H2O
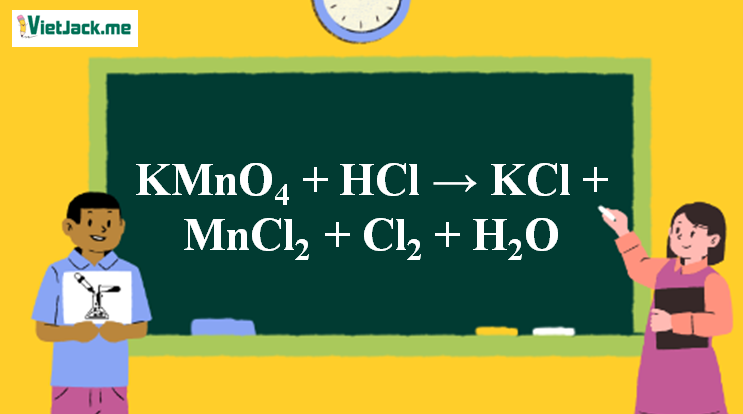
1. Phương trình phản ứng KMnO4 tác dụng HCl đặc
| 2KMnO4 | + 16HCl | → | 2KCl | + 2MnCl2 | + 5Cl2 | + 8H2O |
| (rắn, màu đen) | (lỏng, không màu) | (rắn, trắng) | (rắn) | (khí) | (lỏng, không màu) | |
| 158 | 36,5 | 74,5 | 126 | 71 | 18 |
2. Điều kiện phản ứng giữa KMnO4 và dung dịch HCl đậm đặc
Không có
3. Cách thực hiện phản ứng KMnO4 và HCl đậm đặc
Cho vào ống nghiệm khô một vài tinh thể KMnO4, nhỏ tiếp vào ống vài giọt dung dịch HCl đậm đặc. Đậy kín ống nghiệm bằng nút cao su.
4. Hiện tượng quan sát được
Có khí màu vàng lục thoát ra trong ống nghiệm, chính là Cl2. Vì khí Cl2 thoát ra gây độc chính vì vậy khi làm xong thí nghiệm cần thêm lượng dư dung dịch kiềm để trung hòa lượng HCl dư và tác dụng hết với Cl2 trong bình trước khi đổ ra môi trường
5. Tính chất hóa học của kali pemanganat (KMnO4)
Vì là chất oxi hóa mạnh nên KMnO4 có thể phản ứng với kim loại hoạt động mạnh, axit hay các hợp chất hữu cơ dễ dàng.
5.1. Phản ứng phân hủy bởi nhiệt độ cao
2KMnO4 K2MnO4+ MnO2 + O2
Khi pha loãng tinh thể pemanganat dưới ánh sáng mặt trời trực tiếp, oxi được giải phóng
4KMnO4 + 2H2O → 4KOH + 4MnO2+ 3O2
5.2. Phản ứng với axit
KMnO4 có thể phản ứng với nhiều axit mạnh như H2SO4, HCl hay HNO3, các phương trình phản ứng minh họa gồm:
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
3K2MnO4+ 4HNO3 → 2KMnO4 + MnO2 + 4KNO3 + 2H2O
3K2MnO4 + 2H2SO4→ 2KMnO4 + MnO2 + 2K2SO4 + 2H2O
5.3. Phản ứng với bazơ
Thuốc tím có thể tác dụng với nhiều dung dịch kiềm hoạt động mạnh như KOH, NaOH, phương trình phản ứng minh họa:
4NaOH + 4KMnO4→ 2H2O + O2 + 2K2MnO4 + 2Na2MnO4
5.4. Tính chất oxi hóa của KMnO4
Vì thuốc tím là chất oxy hóa mạnh nên có thể phản ứng với nhiều loại dung dịch và cho ra nhiều sản phẩm khác nhau.
- Trong môi trường axit, mangan bị khử thành Mn2+
2KMnO4+ 5Na2SO3+ 3H2SO4 → 2MnSO4 + 5Na2SO4 + K2SO4 + 3H2O
4KMnO4 + 5C2H5OH + 6H2SO4→ 5CH3COOH + 2K2SO4 + 4MnSO4 + 11H2O
- Trong môi trường trung tính, tạo thành MnO2 có cặn màu nâu.
2KMnO4 + 3K2SO3 + H2O → 3K2SO4 + 2MnO2 + 2KOH
- Trong môi trường kiềm, bị khử thành MnO42-
2KMnO4 + Na2SO3 + 2KOH → 2K2MnO4 + Na2SO4+ H2O
5.5. Ứng dụng
Thuốc tím được dùng làm thuốc khử trùng, sát khuẩn hiệu quả và là thuốc diệt nấm.
Được sử dụng trong điều trị các bệnh ngoài da như eczema, viêm da, mụn trứng cá, nấm,…
Thuốc tím pha loãng có thể điều trị các vết thương có mủ, rỉ nước và phồng rộp.
6. Tính chất hóa học của HCl
Dung dịch axit HCl có đầy đủ tính chất hoá học của một axit mạnh.
6.1. Tác dụng chất chỉ thị
Dung dịch HCl làm quì tím hoá đỏ (nhận biết axit)
HCl → H+ + Cl-
6.2. Tác dụng với kim loại
Tác dụng với KL (đứng trước H trong dãy Bêkêtôp) tạo muối (với hóa trị thấp của kim loại) và giải phóng khí hidrô (thể hiện tính oxi hóa)
Fe + 2HCl 
2Al + 6HCl 
Cu + HCl → không có phản ứng
6.3. Tác dụng với oxit bazo và bazo
Sản phẩm tạo muối và nước
NaOH + HCl → NaCl + H2 O
CuO + 2HCl 
Fe2 O3 + 6HCl
6.4. Tác dụng với muối (theo điều kiện phản ứng trao đổi)
CaCO3 + 2HCl → CaCl2 + H2O + CO2↑
AgNO3 + HCl → AgCl↓ + HNO3
(dùng để nhận biết gốc clorua )
Ngoài tính chất đặc trưng là axit , dung dịch axit HCl đặc còn thể hiện vai trò chất khử khi tác dụng chất oxi hoá mạnh như KMnO4, MnO2, K2 Cr2O7, MnO2, KClO3 ……
4HCl + MnO2 
K2 Cr2 O7 + 14HCl → 3Cl2 + 2KCl + 2CrCl3 + 7H2 O
Hỗn hợp 3 thể tích HCl và 1 thể tích HNO3 đặc được gọi là hỗn hợp nước cường toan ( cường thuỷ) có khả năng hoà tan được Au ( vàng)
3HCl + HNO3 → 2Cl + NOCl + 2H2O
NOCl → NO + Cl
Au + 3Cl → AuCl3
7. Bài tập vận dụng liên quan
Câu 1. Người ta thu được khí oxi bằng cách đẩy không khí là dựa vào tính chất nào?
A. Khí oxi nhẹ hơn không khí.
B. Khí oxi nặng hơn không khí.
C. Khí oxi dễ trộn lẫn với không khí.
D. Khí oxi ít tan trong nước.
Lời giải:
Câu 2. Không dùng cách nào sau đây để điều chế oxi trong phòng thí nghiệm?
A. Đun nóng KMnO4.
B. Đung nóng KClO3 với xúc tác MnO2.
C. Phân hủy H2O2.
D. Chưng cất phân đoạn không khí lỏng.
Lời giải:
2KMnO4 K2MnO4 + MnO2 + O2
2KClO3 2KCl + 3O2
H2O2 H2O + O2
Câu 3. Chọn định nghĩa phản ứng phân huỷ đầy đủ nhất:
A. Phản ứng phân huỷ là phản ứng hoá học trong đó một chất sinh ra một chất mới.
B. Phản ứng phân huỷ là phản ứng hoá học trong đó một chất sinh ra hai chất mới.
C. Phản ứng phân huỷ là phản ứng hoá học trong đó một chất sinh ra hai hay nhiều chất mới.
D. Phản ứng phân huỷ là phản ứng hoá học có chất khí thoát ra.
Lời giải:
Phản ứng phân huỷ là phản ứng hoá học trong đó một chất sinh ra hai hay nhiều chất mới.
Câu 4. Trong phòng thí nghiệm người ta điều chế oxi bằng cách nhiệt phân KClO3 và KMnO4 hoặc KNO3. Vì lí do nào sau đây?
A. Dễ kiếm, rẻ tiền
B. Giàu oxi và dễ phân hủy ra oxi
C. Phù hợp với thiết bị hiện đại
D. Không độc hại
Lời giải:
Câu 5. Trong phòng thí nghiệm cần điều chế 4,48 lít O2 (đktc). Dùng chất nào sau đây có khối lượng nhỏ nhất.
A. KMnO4
B. KClO3
C. KNO3
D. Không khí
Lời giải:
Câu 6. Cho 14,6 gam HCl tác dụng hết với KMnO4, thu được V lít khí Cl2 (đktc). Giá trị của V là
A. 8,96
B. 2,8
C. 5,60
D. 11,20
Lời giải:
Phương trình phản ứng hóa học
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
⇒ nHCl= 14,636,5 = 0,4 (mol)
⇒ nCl2 = 0,4.516 = 0,125 mol
V = 0,125 . 22,4 = 2,8 (l)
Câu 7. Trong phòng thí nghiệm, người ta thường điều chế clo bằng cách
A. điện phân nóng chảy NaCl.
B. cho dung dịch HCl đặc tác dụng với MnO2, đun nóng.
C. điện phân dung dịch NaCl có màng ngăn.
D. cho F2 đẩy Cl2 ra khỏi dung dịch NaCl.
Lời giải:
Câu 8. Chất dùng để làm khô khí Cl2 ẩm là
A. dung dịch H2SO4 đậm đặc.
B. Na2SO3 khan.
C. CaO.
D. dung dịch NaOH đặc.
Lời giải:
Câu 9. Đặc điểm chung của các đơn chất halogen (F2, Cl2, Br2, I2):
A. ở điều kiện thường đều là chất khí
B. tác dụng mãnh liệt với nước.
C. vừa có tính oxi hóa, vừa có tính khử.
D. tính chất hóa học cơ bản là tính oxi hóa.
Lời giải:
Các đơn chất halogen có tính chất hóa học cơ bản là tính oxi hóa.
Câu 10. Cho clo vào nước, thu được nước clo Nước clo là hỗn hợp gồm các chất:
A. HCl, HClO
B. HClO, Cl2, H2O
C. H2O, HCl, HClO
D. H2O, HCl, HClO, Cl2
Lời giải:
Cl2 có phản ứng thuận nghịch với nước:
H2O + Cl2 → HCl + HClO (axit clohiđric và axit hipoclorơ)
Ngoài ra clo tan trong nước theo kiểu vật lí
=> trong nước clo có chứa Cl2, HCl, HClO, H2O.
Câu 11. Dãy gồm các chất đều tác dụng được với dung dịch HCl loãng là
A. NaNO3, CaCO3, Fe(OH)3
B. KHCO3, AgNO3, CuO
C. FeS, BaSO4, NaOH
D. AgNO3, (NH4)2CO3, CuS
Lời giải:
Phương trình phản ứng
HCl + KHCO3 → H2O + CO2 + KCl
AgNO3 + HCl → AgCl↓ + HNO3
CuO + 2HCl → CuCl2+ H2O
Câu 12. Nhiệt phân cùng một lượng số mol mỗi chất sau: KMnO4; KClO3; KNO3; H2O2. Chất nào thu được lượng khí oxi lớn nhất?
A. KMnO4
B. KClO3
C. KNO3
D. H2O2
Lời giải:
Giả sử lấy 1 mol mỗi chất
Phương trình hóa học nhiệt phân:
2KMnO4 K2MnO4+ MnO2 + O2
2 mol 1 mol
1 mol → 0,5 mol
2KClO3 2KCl + 3O2
2 mol 3 mol
1 mol → 1,5 mol
2KNO3 2KNO2 + O2
2 mol 1 mol
1 mol → 0,5 mol
2H2O2 2H2O + O2
2 mol 1 mol
1 mol → 0,5 mol
=> chất thu được lượng khí oxi lớn nhất là KClO3
Câu 13. Cho KMnO4 tác dụng với HCl đặc thu được khí A. Dẫn khí thu được vào dung dịch KOH ở nhiệt độ thường và đun nóng. Cho biết hiện tượng xảy ra
A. Mất màu dung dịch thuốc tím, có khí vàng lục thoát ra, sau đó dung dịch không màu
B. Mất màu dung dịch thuốc tím, sau đó dung dịch không màu
C. Mất màu dung dịch thuốc tím, có khí không màu thoát ra, sau đó dung dịch không màu
D. Mất màu dung dịch thuốc tím, có khí vàng lục thoát ra.
Lời giải:
KMnO4 tan trong HCl làm mất màu dung dịch thuốc tím đồng thời có khí màu vàng lục thoát ra, tiếp tục sục khí Clo vào KOH ta được dung dịch ko màu.
Phương trình hóa học
2KMnO4+ 16HCl→ 2KCl + 2MnCl2 + 5Cl2+ 8H2O
Cl2 + 2KOH → KCl + KClO + H2O
Câu 14. Phát biểu nào sau đây đúng?
A. Ozon có tính oxi hóa mạnh nên được dùng để sát khuẩn nước sinh hoạt, tẩy trắng tinh bột, dầu ăn và nhiều chất khác.
B. Oxi và ozon đều có tính oxi hóa mạnh nhưng tính oxi hóa của oxi mạnh hơn ozon.
C. Fe tác dụng với Cl2 và H2SO4 loãng đều tạo ra muối sắt (II).
D. H2S chỉ có tính oxi hóa và H2SO4 chỉ có tính khử.
Lời giải:
A. Ozon có tính oxi hóa mạnh nên được dùng để sát khuẩn nước sinh hoạt, tẩy trắng tinh bột, dầu ăn và nhiều chất khác: Đúng.
B. Oxi và ozon đều có tính oxi hóa mạnh nhưng tính oxi hóa của oxi mạnh hơn ozon: Sai. Vì ozon có tính oxi hóa mạnh hơn oxi.
C. Fe tác dụng với Cl2 và H2SO4 loãng đều tạo ra muối sắt (II): Sai.
D. H2S chỉ có tính oxi hóa và H2SO4 chỉ có tính khử:Sai. Vì H2S chỉ thể hiện tính khử, H2SO4 chỉ thể hiện tính oxi hóa.
Câu 15. Nhờ đặc tính nào sau đây mà nước được coi là dung môi tốt để hòa tan các chất:
A. Các liên kết hidro luôn bền vững
B. Tính phân cực
C. Các liên kết hidro luôn bị bẻ gãy và tái tạo liên tục
D. Trạng thái lỏng
Lời giải:
Nhờ tính phân cực của phân tử mà chúng có thể dễ dàng liên kết các chất tan lại với nhau đồng thời liên kết với chất tan. Đóng vai trò cầu nối giữa các phân tử chất tan.
Câu 16. Dãy các chất đều làm mất màu dung dịch thuốc tím là
A. Etilen, axetilen, anđehit fomic, toluen
B. Axeton, etilen, anđehit axetic, cumen
C. Benzen, but-1-en, axit fomic, p-xilen
D. Xiclobutan, but-1-in, m-xilen, axit axetic
Lời giải:
Etilen, axetilen, anđehit fomic, toluen
Phương trình phản ứng hóa học
3C2H4 + 2KMnO4 + 4H2O → 3C2H4(OH)2 + 2MnO2 + 2KOH
3C2H2 + 8KMnO4 + 4H2O → 3(COOH)2 + 8MnO2 + 8KOH
2KMnO4 + 3HCHO + H2O → 3HCOOH + 2KOH + 2MnO2
C6H5CH3 + 2KMnO4 → C6H5COOK + KOH + 2MnO2 + H2O
Câu 17. Cho các phát biểu sau:
(a) Ankan có phản ứng cộng Cl2.
(b) Benzen không làm mất màu dung dịch thuốc tím ở điều kiện thường.
(c) Toluen làm mất màu dung dịch thuốc tím khi đun nóng.
(d) Benzen và naphtalen đều là dung môi hữu cơ thông dụng.
(e) Axit axetic hòa tan được Cu(OH)2 ở điều kiện thường.
(g) Axetilen có phản ứng tráng bạc.
Trong các phát biểu trên, số phát biểu đúng là
A. 6.
B. 3.
C. 4.
D. 5.
Lời giải:
(a) sai vì ankan không có phản ứng cộng với Cl2.
(b) đúng vì benzen không làm mất màu dung dịch thuốc tím ở điều kiện thường.
(c) đúng.
(d) sai. Naphtalen không phải là dung môi hữu cơ thông dụng.
(e) đúng.
(g) sai.
Câu 18. Cho các nhận định sau
(a) Nhận biết Khí CH4 và C2H4 người ta sử dụng hóa chất nào dưới đây dung dịch brom.
(b) Thành phần chính của cồn 750 mà trong y tế thường dùng để sát trùng là metanol.
(c) Để ủ hoa quả nhanh chín và an toàn hơn, có thể thay thế C2H2 bằng C2H4.
(d) Polietilen được điều chế bằng phản ứng trùng ngưng
(e) Thủy phân hoàn toàn vinyl axetat bằng NaOH thu được natri axetat và anđehit axetic
Số phát biểu sai là
A. 1
B. 2
C. 4
D. 3
Lời giải:
(b) sai vì Thành phần chính của cồn 750 mà trong y tế thường dùng để sát trùng là etanol
(d) Sai vì: Polietilen được điều chế bằng phản ứng trùng hợp
=> có 2 phát biểu sai
Xem thêm các phương trình hóa học khác:
Xem thêm các chương trình khác:
- Các dạng bài tập Tiếng Anh thông dụng nhất
- 3000 câu hỏi ôn tập môn Tiếng Anh có đáp án
- Toàn bộ kiến thức về cụm động từ | Định nghĩa và cách dùng
- 500 đoạn văn Tiếng Anh thông dụng nhất và cách làm
- 1000 câu hỏi ôn tập môn Công nghệ có đáp án
- 1000 câu hỏi ôn tập Giáo dục công dân
- 15000 câu hỏi ôn tập môn Toán có đáp án
- Wiki Toán | Khái niệm, định lí, tính chất, dạng bài, công thức
- Tuyển tập đề thi + chuyên đề ôn thi Toán Kangaroo các cấp độ (có đáp án 2024)
- 3000 câu hỏi ôn tập môn Vật lí có đáp án
- Tổng hợp Dạng bài - Công thức môn Vật lí
- 2000 câu hỏi ôn tập môn Tin học có đáp án
- 3000 câu hỏi ôn tập môn Lịch sử có đáp án
- 3000 câu hỏi ôn tập môn Địa lí có đáp án
- 2000 câu hỏi ôn tập môn Sinh học có đáp án
- Tổng hợp Dạng bài - Công thức môn Sinh học
- Tổng hợp về các tác giả văn học
- 3000 câu hỏi ôn tập môn Ngữ văn có đáp án
- Tổng hợp kiến thức Ngữ Văn
- Tuyển tập truyện dân gian, truyền thuyết, cổ tích,... Việt Nam
- Tổng hợp các đề đọc - hiểu có đáp án chi tiết
- Trò chơi Powerpoint | Game Powerpoint
- Tổng hợp bài thu hoạch BDTX Giáo viên mầm non (2025) theo Thông tư 12
- Tổng hợp bài thu hoạch BDTX Giáo viên tiểu học (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THCS (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THPT (2025)
