Fe3O4 +H2SO4 đặc → Fe2(SO4)3 + H2O + SO2↑ | Fe3O4 ra Fe2(SO4)3 | Fe3O4 ra SO2 | H2SO4 ra Fe2(SO4)3
Fe3O4 +H2SO4 đặc → Fe2(SO4)3 + H2O + SO2↑ là loại phản ứng oxi hóa - khử. Bài viết này cung cấp đầy đủ thông tin về phương trình hóa học đã được cân bằng, điều kiện các chất tham gia phản ứng, hiện tượng (nếu có), ... Mời các bạn đón xem:
Phản ứng Fe3O4 +H2SO4đặc → Fe2(SO4)3 + H2O + SO2
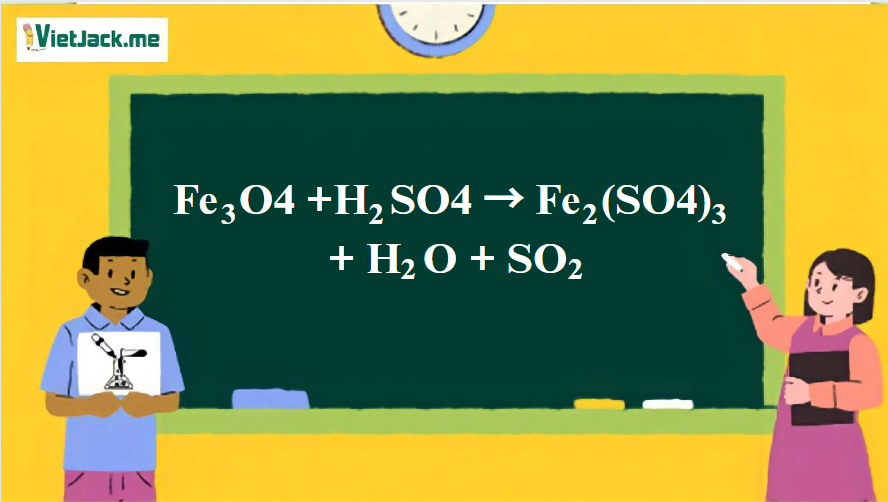
1. Phương trình phản ứng Fe3O4 tác dụng với H2SO4 đặc
2Fe3O4 + 10H2SO4 → 3Fe2(SO4)3 + SO2↑ + 10H2O
2. Cân bằng phản ứng Fe3O4 + H2SO4 → Fe2(SO4)3 + SO2 + H2O
+83Fe3O4 + H2+6SO4 → +3Fe2(SO4)3 + +4SO2 + H2O
2×1×|3+83Fe→3+3Fe +1e+6S+2e→+4S
Phương trình hóa học: 2Fe3O4 + 10H2SO4 → 3Fe2(SO4)3 + SO2↑ + 10H2O
3. Điều kiện phản ứng Fe3O4 ra Fe2(SO4)3
Phản ứng xảy ra ngay ở điều kiện thường.
4. Bản chất của các chất tham gia phản ứng
4.1 Bản chất của Fe3O4
Fe3O4 có tính oxit bazơ và tác dụng với dung dịch axit như HCl và H2SO4 loãng để tạo ra hỗn hợp muối sắt (II) và sắt (III).
4.2 Bản chất của H2SO4
H2SO4 tác dụng với oxit bazơ tạo thành muối mới và nước.
5. Tính chất hóa học của Fe3O4
Định nghĩa: Là hỗn hợp của hai oxit FeO, Fe2O3. Có nhiều trong quặng manhetit, có từ tính.
Công thức phân tử Fe3O4
5.1 Tính oxit bazơ
Fe3O4 tác dụng với dung dịch axit như HCl, H2SO4 loãng tạo ra hỗn hợp muối sắt (II) và sắt (III).
Fe3O4 + 8HCl → 2FeCl3 + FeCl2 + 4H2O
Fe3O4+ 4H2SO4 loãng→ Fe2(SO4)3+ FeSO4 + 4H2O
5.2 Tính khử
Fe3O4 là chất khử khi tác dụng với các chất có tính oxi hóa mạnh:
3Fe3O4 + 28HNO3 → 9Fe(NO3)3 + NO + 14H2O
5.3 Tính oxi hóa
Fe3O4 là chất oxi hóa khi tác dụng với các chất khử mạnh ở nhiệt độ cao như: H2, CO, Al:
Fe3O4 + 4H2 3Fe + 4H2O
Fe3O4+ 4CO 3Fe + 4CO2
3Fe3O4 + 8Al 4Al2O3 + 9Fe
5.4. Ứng dụng
- Quặng manhetit có hàm lượng sắt cao nhất được dùng trong ngành luyện gang, thép.
- Fe3O4 hạt nano được dùng để dánh dấu tế bào và xử lí nước bị nhiểm bẩn.
5.5. Điều chế
- Trong tự nhiên oxit sát từ là thành phần quặng manhetit.
- Đốt cháy sắt trong oxi không khí thu được oxit sắt từ.
3Fe + 2O2 → Fe3O4
- Nung nóng Fe trong nước dạng hơi ở nhiệt độ < 570độC
3Fe + 4H2O → Fe3O4 + 4H2
6. Tính chất của H2SO4 đặc
6.1 Tính oxi hóa mạnh
+ Axit sunfuric đặc oxi hoá hầu hết các kim loại (trừ Au và Pt) tạo muối hoá trị cao và thường giải phóng SO2 (có thể H2S, S nếu kim loại khử mạnh như Mg).
2Fe + 6H2SO4 to→ Fe2(SO4)3 + 3SO2 + 6H2O
Cu + 2H2SO4 to→ CuSO4 + SO2 + 2H2O
Chú ý: Al, Fe, Cr bị thụ động hóa trong H2SO4 đặc, nguội.
+ Tác dụng với nhiều phi kim:
C + 2H2SO4 to→ CO2 + 2SO2 + 2H2O
S + 2H2SO4 to→ 3SO2 + 2H2O
+ Tác dụng với nhiều hợp chất có tính khử:
2FeO + 4H2SO4 to→ Fe2(SO4)3 + SO2 + 4H2O
2KBr + 2H2SO4 to→ Br2 + SO2 + 2H2O + K2SO4
6.2 H2SO4 đặc có tính háo nước
Axit sunfuric đặc chiếm nước kết tinh của nhiều muối ngậm nước, hoặc chiếm các nguyên tố H và O (thành phần của nước) trong nhiều hợp chất.
Ví dụ:
Khi cho axit H2SO4 đặc vào đường, đường sẽ hóa thành than.
C12H22O11 H2SO4 đ→12C + 11H2O
Sau đó một phần C sinh ra lại bị H2SO4 đặc oxi hóa:
C + 2H2SO4 (đặc) → CO2 + 2SO2 + 2H2O
7. Hiện tượng hóa học
Khi cho Fe3O4 tác dụng với dung dịch axit H2SO4 đặc sản phẩm sinh ra muối sắt(III) sunfat và có khí mùi hắc lưu huỳnh đioxit thoát ra.
8. Bài tập vận dụng liên quan
Câu 1. Cho các chất Cu, Fe, Ag và các dung dịch HCl, CuSO4, FeCl2, FeCl3. Số cặp chất có phản ứng với nhau là:
A. 1
B. 2
C. 3
D. 4
Hướng dẫn giải
Đáp án D
Cu tác dụng với FeCl3
Cu + 2 FeCl3 → CuCl2 + 2 FeCl2
Fe tác dụng với dung dịch HCl, CuSO4, FeCl3
Fe + 2HCl → FeCl2 + H2
CuSO4 + Fe→ Cu + FeSO4
Fe + 2FeCl3 → 3FeCl2
Ag không tác dụng với dung dịch nào.
Câu 2. Dung dịch nào dưới đây phản ứng với Fe tạo thành hợp chất F e(II)?
A. H2SO4
B. dung dịch HNO3 loãng
C. dung dịch AgNO3 dư
D. dung dịch HCl đặc
Hướng dẫn giải
Đáp án D
Phương trình phản ứng minh họa
Fe + H2SO4 loãng → FeSO4 + H2
Fe + 4HNO3 → Fe(NO3)3 + NO↑ + 2H2O
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag
Fe(NO3)2 + AgNO3 dư → Fe(NO3)3 + Ag
Fe + 2HCl đặc → FeCl2 + H2
Câu 3. Dãy kim loại nào dưới đây tác dụng với dung dịch H2SO4 loãng?
A. Al, Mg, Cu
B. Fe, Mg, Ag
C. Al, Fe, Mg
D. Al, Fe, Au
Hướng dẫn giải
Đáp án C
A loại vì Cu không tác dụng với dung dịch H2SO4 loãng
B Loại vì Ag không tác dụng với dung dịch H2SO4 loãng
D Loại vì Au không tác dụng với dung dịch H2SO4 loãng
Phương trình phản ứng minh họa
2Al + 3H2SO4 loãng → Al2(SO4)3 + 3H2
Fe + H2SO4 loãng → FeSO4 + H2
Mg + H2SO4 loãng → MgSO4 + H2
Câu 4. Cho phương trình phản ứng hóa học sau:
Al + H2SO4 → Al2(SO4)3 + SO2 + H2O
Tổng hệ số cân bằng tối giản của phương trình trên là:
A. 17
B. 18
C. 19
D. 20
Hướng dẫn giải
Đáp án B
Cân bằng phương trình phản ứng
2Al + 6H2SO4 → Al2(SO4)3 + 3SO2 + 6H2O
Tổng hệ số cân bằng tối giản của phương trình trên là: 18
Câu 5. Cho mẩu Cu vào dung dịch FeCl3. Hiện tượng xảy ra là:
A. Kim loại Fe màu trắng bám vào Cu, dung dịch chuyển sang màu xanh.
B. Đồng tan ra, sủi bọt khí không màu và kết tủa màu trắng.
C. Không hiện tượng, vì phản ứng không xảy ra.
D. Đồng tan ra, dung dịch từ màu đỏ nâu chuyển sang màu xanh.
Hướng dẫn giải
Đáp án D
Phản ứng hóa học xảy ra khi cho mẩu Cu vào dung dịch FeCl3:
Cu + 2FeCl3 → CuCl2 + FeCl2
nâu đỏ xanh
⟹ Đồng tan ra, dung dịch từ màu nâu đỏ chuyển sang màu xanh.
Câu 6. Tiến hành các thí nhiệm:
(1) Nhúng thanh Cu vào dung dịch FeCl3;
(2) Nhúng thanh Al dư vào dung dịch FeCl3;
(3) Nhúng thanh hợp kim Al-Cu vào dung dịch HCl;
(4) Nhúng thanh Ag vào dung dịch H2SO4 loãng;
(5) Nhúng thanh hợp kim Zn-Fe vào dung dịch Na2SO4
Số trường hợp xuất hiện ăn mòn điện hoá là
A. 4
B. 3
C. 2
D. 1
Hướng dẫn giải
Đáp án B
Câu 7. Có các nguyên liệu:
(1). Quặng sắt.
(2). Quặng Cromit.
(3). Quặng Boxit.
(4). Than cốc.
(5). Than đá.
(6). CaCO3.
(7). SiO2.
Những nguyên liệu dùng để luyện gang là:
A. (1), (3), (4), (5).
B. (1), (4), (7).
C. (1), (3), (5), (7).
D. (1), (4), (6), (7).
Hướng dẫn giải
Đáp án D
Nguyên liệu dùng để luyện ngang là quặng sắt có chưa 30-95% oxi sắt, không chứa hoặc chứa rất ít S,P
Than cốc(không có trong tự nhiên,phải điều chế từ than mỡ) có vai trò cung cấp nhiệt khi cháy, tạo ra chất khử là CO và tạo thành gang
Chất chảy CaCO3 ở nhiệt độ cao bị phân hủy thành CaO, sao đó hóa hợp với SiO2 là chất khó nóng cháy có trong quặng sắt thành xỉ silicat dễ nóng chảy, có khối lượng riêng nhỉ nổi lên trên gang
Câu 8. Nhận định nào không đúng về khả năng phản ứng của sắt với nước?
A. Ở nhiệt độ cao (nhỏ hơn 570oC), sắt tác dụng với nước tạo ra Fe3O4 và H2.
B. Ở nhiệt độ lớn hơn 1000oC, sắt tác dụng với nước tạo ra Fe(OH)3.
C. Ở nhiệt độ lớn hơn 570oC, sắt tác dụng với nước tạo ra FeO và H2.
D. Ở nhiệt độ thường, sắt không tác dụng với nước.
Hướng dẫn giải
Đáp án B
Ở nhiệt độ thường, sắt không tác dụng với nước.
Ở nhiệt độ cao, sắt khử được hơi nước:
3Fe + 4H2O → Fe3O4 + 4H2(to < 570oC)
Fe + H2O → FeO + H2 (to > 570oC)
→ Ở nhiệt độ lớn hơn 1000oC, sắt tác dụng với H2O tạo ra FeO
Câu 9. Cho ít bột Fe vào dung dịch AgNO3 dư. Kết thúc phản ứng được dung dịch X. Dung dịch X gồm muối :
A. Fe(NO3)2
B. Fe(NO3)2; AgNO3
C. Fe(NO3)3; AgNO3
D. Fe(NO3)2; Fe(NO3)3
Hướng dẫn giải
Đáp án C
Cho một ít bột Fe vào AgNO3dư:
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag↓
Fe(NO3)2 + AgNO3 dư → Fe(NO3)3 + Ag↓
→ Dung dịch X gồm Fe(NO3)3, AgNO3
Câu 10. Tiến hành các thí nghiệm sau:
(a) FeO tác dụng với dung dịch HNO3
(b) Fe(NO3)2 tác dụng với dung dịch HCl
(c) FeCO3 tác dụng với dung dịch H2SO4
(d) K tác dụng với dung dịch Fe2(SO4)3
(e) Ba tác dụng với dung dịch FeCl2
Sau khi phản ứng xảy ra hoàn toàn, số thí nghiệm tạo ra chất khí là?
A. 2
B. 3
C. 5
D. 4
Hướng dẫn giải
Đáp án C
Xét sản phẩm của từng phản ứng => Số phương trình thỏa mãn đề bài
(a) 3FeO + 10HNO3 → 3Fe(NO3)3 + NO + 5H2O
(b) 3Fe2+ + 4H+ + NO3- → 3Fe3+ + NO + 2H2O
(c) FeCO3 + H2SO4 → FeSO4 + CO2 + H2O
(d) K + H2O → KOH + H2
6KOH + Fe2(SO4)3 → 2Fe(OH)3 + 3K2SO4
(e) Ba + H2O → Ba(OH)2 + H2
Ba(OH)2 + FeCl2→ BaCl2 + Fe(OH)2
→ Số thí nghiệm sinh ra chất khí là: 5
Câu 11. Cho sơ đồ chuyển hóa:
Fe → FeCl3 → Fe(OH)3 (mỗi mũi tên ứng với một phản ứng). Hai chất X, Y lần lượt là
A. HCl, NaOH
B. HCl, Al(OH)3
C. KCl, Cu(OH)2
D. Cl2, KOH
Hướng dẫn giải
Đáp án D
Ta có phương trình phản ứng:
2Fe + 3Cl2 → 2FeCl3
FeCl3+ 3KOH → Fe(OH)3 + 3KCl
Câu 12. Cặp dung dịch nào sau đây phản ứng với nhau tạo ra chất khí?
A. NH4Cl và AgNO3.
B. NaOH và H2SO4.
C. Ba(OH)2 và NH4Cl.
D. Na2CO3 và KOH.
Hướng dẫn giải
Đáp án C
A. NH4Cl + AgNO3→ AgCl ↓ + NH4NO3
B. 2NaOH + H2SO4→ Na2SO4 + 2H2O
C. Ba(OH)2+ 2NH4Cl → BaCl2 + 2NH3 ↑ + 2H2O
D. Na2CO3không phản ứng với KOH
Câu 13. Dãy gồm các chất đều phản ứng được với Fe(NO3)2 là:
A. NaOH, Mg, KCl, H2SO4.
B. AgNO3, Br2, NH3, HCl.
C. AgNO3, NaOH, Cu, FeCl3
D. KCl, Br2, NH3, Zn.
Hướng dẫn giải
Đáp án B
A. Loại KCl không pư
B. Thỏa mãn
AgNO3+ Fe(NO3)2→ Fe(NO3)3 + Ag↓
3Br2 + 3Fe(NO3)2 → Fe(NO3)3 + 2FeBr3
2NH3 + 2H2O + Fe(NO3)2 → Fe(OH)2 + 2NH4NO3
12HCl + 9Fe(NO3)2→ 5Fe(NO3)3 + 4FeCl3 + 3NO + 6H2O
C. Loại Cu, FeCl3
D. Loại KCl
Câu 14. Để phân biệt các dung dịch loãng: HCl, HNO3, H2SO4 có thể dùng thuốc thử nào sau đây?
A. Dung dịch Ba(OH)2 và bột Cu kim loại
B. Kim loại sắt và đồng
C. Dung dịch Ca(OH)2
D. Kim loại nhôm và sắt
Hướng dẫn giải
Đáp án A
Để nhận biết 3 axit HCl, HNO3, H2SO4 ta dùng BaCl2 và Cu vì
BaCl2 giúp nhận ra H2SO4 do chỉ tạo kết tủa trắng với chất này
Cu nhận ra HCl vì không xảy ra phản ứng, còn HNO3 tạo ra khí không màu hóa nâu trong không khí
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO↑ + 4H2O
Câu 15. Cho 2,24 gam Fe tác dụng với oxi, thu được 3,04 gam hỗn hợp X gồm 2 oxit. Để hoà tan hết X cần thể tích dung dịch HCl 1M là
A. 25 ml.
B. 50 ml.
C. 100 ml.
D. 150 ml.
Hướng dẫn giải
Đáp án C
Áp dụng bảo toàn nguyên tố ta có:
nH = 2nO = 2.(3,04 − 2,24)16= 0,1 mol
Thể tích dung dịch HCl 1M là
V = 0,1.10002 = 50 ml
Câu 16. Cho m gam bột Fe vào dung dịch HNO3 lấy dư, ta được hỗn hợp gồm hai khí NO2 và NO có VX= 17,92 lít (đktc) và tỉ khối đối với O2 bằng 2,625. Thành phần phần trăm theo thể tích của NO, NO2 và khối lượng m của Fe đã dùng là
A. 25% và 75%; 2,24 gam.
B. 25% và 75%; 22,4 gam.
C. 35% và 65%; 22,4 gam.
D. 45% và 55%; 2,24 gam.
Hướng dẫn giải
Đáp án B
Gọi số mol NO2 và NO lần lượt là a, b
Ta có hệ phương trình:
a + b = 0,8
46a + 30b = 0,8.(2,625.32)
=> a = 0,6 và b = 0,2
%VNO2 = 75% ;
%VNO = 25%
N+5 + 1e → N+4 (NO2)
0,6 ← 0,6
N+5 + 3e → N+2 (NO)
0,6 ← 0,2
Fe0 → Fe+3 + 3e
0,1 ← 0,3
=> mFe = 0,4.56 = 22,4 gam
Câu 17. Hỗn hợp A gồm FeO, Fe2O3, Fe3O4 (trong đó số mol FeO bằng số mol Fe2O3). Hòa tan 4,64 gam A trong dung dịch H2SO4 loãng dư được 200 ml dung dịch X . Tính thể tích dung dịch KMnO4 0,1M cần thiết để chuẩn độ hết 100 ml dung dịch X?
A. 0,1 lít
B. 0,12 lít
C. 0,2 lít
D. 0,24 lít
Hướng dẫn giải
Đáp án C
Vì số mol của FeO bằng số mol của Fe2O3 nên ta coi hỗn hợp là Fe3O4
Ta có phương trình hóa học
Fe3O4 + 4H2SO4→ FeSO4 + Fe2(SO4)3 +4H2O
0,02 → 0,02
Trong 100 ml X sẽ có 0,01 mol FeSO4 nên:
10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4+ 2MnSO4 + 8H2O
→nKMnO4 = 0,02 mol → VKMnO4 = 0,020,1= 0,2 lit
Câu 18. Nung hỗn hợp gồm 0,3 mol Fe và 0,2 mol S cho đến khi kết thúc phản ứng thu được chất rắn A. Cho A tác dụng với dung dịch HCl dư, thu được khí B. Tỉ khối của B so với không khí là:
A. 0,8045
B. 0,7560
C. 0,7320
D. 0,9800
Hướng dẫn giải
Đáp án A
Ta có: Số mol của nFe phả ứng = nS = 0,2 mol
X gồm: Fe (dư 0,1) và FeS (0,2)
→ Khí: H2 (0,1) và H2S: 0,2
→ MY = (0,1. 2 + 0,2. 34) : 0,3 = 703→ d(Y/ kk) = (703) : 29 = 0,8046
Câu 19. Hòa tan hết m gam Fe bằng 400ml dung dịch HNO3 1M. Sau khi phản ứng xảy ra hoàn toàn, thu được dung dịch chứa 26,44 gam chất tan và khí NO (sản phẩm khử duy nhất). Giá trị của m là:
A. 7,84
B. 6,12
C. 5,60
D. 12,24
Hướng dẫn giải
Đáp án A
nHNO3 = 0,4 mol ⇒nHNO3= 0,4.63 = 25,2 gam
Fe + 4HNO3 → Fe(NO3)3 + NO + H2O (1)
Phản ứng (1) xảy ra, khối lượng chất tan giảm đi, mà theo đề bài, khối lượng chất tan là 26,44 gam > 25,2 gam nên xảy ra phản ứng hoà tan Fe dư
2Fe3+ + Fe → 3Fe2+ (2)
⇒ phản ứng (1) xảy ra hoàn toàn,
⇒ mFe(1) = 5,6 gam ⇒ mFe(2) = 26,44 – 0,1.242 = 2,24 gam
mFe = 5,6 + 2,24 = 7,84 gam
Câu 20. Cho 8,4 gam bột sắt vào 100 ml dung dịch gồm AgNO3 2M và Cu(NO3)2 1M; khi các phản ứng xảy ra hoàn toàn thu được m gam chất rắn X. Giá trị của m là
A. 24,8
B. 32
C. 21,6
D. 12,24
Hướng dẫn giải
Đáp án A
nFe = 0,15 mol; nAgNO3= 0,2mol; nCu(NO3)2 = 0,1 mol
Nhận xét: 2nFe> nAg => không xảy ra phản ứng Ag+ + Fe2+ → Ag + Fe3+ => Fe tạo muối Fe2+
ne Fe cho tối đa = 0,15.2 = 0,3 mol
ne Ag+ nhận tối đa = 0,2 mol
ne Cu2+ nhận tối đa = 0,1.2 = 0,2 mol
Ta thấy : 0,2 < ne Fe cho tối đa < 0,2 + 0,2
=> Ag+ phản ứng hết, Cu2+ phản ứng 1 phần
=> ne Cu2+ nhận tạo Cu = 0,3 – 0,2 = 0,1 mol => nCu = 0,05 mol
=> m = mAg + mCu = 0,2.108 + 0,05.64 = 24,8 gam
Câu 21. Hòa tan hoàn toàn a gam một oxit sắt bằng dung dịch H2SO4đậm đặc vừa đủ, có chứa 0,075 mol H2SO4, thu được b gam một muối và có 168 ml khí SO2 (đktc duy nhất thoát ra). Giá trị của b là
A. 8.
B. 9.
C. 16.
D. 12.
Hướng dẫn giải
Đáp án B
Ta có: nSO2= 0,0075 mol
nSO42− = nH2SO4nSO2= 0,0675 mol
Sau phản ứng muối thu được là:
Fe2(SO4)3 = x mol → 3x (mol) SO4(2-).
=> x = 0,0675/3 = 0,0225 mol => b = 9 gam
Xem thêm các chương trình khác:
- Các dạng bài tập Tiếng Anh thông dụng nhất
- 3000 câu hỏi ôn tập môn Tiếng Anh có đáp án
- Toàn bộ kiến thức về cụm động từ | Định nghĩa và cách dùng
- 500 đoạn văn Tiếng Anh thông dụng nhất và cách làm
- 1000 câu hỏi ôn tập môn Công nghệ có đáp án
- 1000 câu hỏi ôn tập Giáo dục công dân
- 15000 câu hỏi ôn tập môn Toán có đáp án
- Wiki Toán | Khái niệm, định lí, tính chất, dạng bài, công thức
- Tuyển tập đề thi + chuyên đề ôn thi Toán Kangaroo các cấp độ (có đáp án 2024)
- 3000 câu hỏi ôn tập môn Vật lí có đáp án
- Tổng hợp Dạng bài - Công thức môn Vật lí
- 2000 câu hỏi ôn tập môn Tin học có đáp án
- 3000 câu hỏi ôn tập môn Lịch sử có đáp án
- 3000 câu hỏi ôn tập môn Địa lí có đáp án
- 2000 câu hỏi ôn tập môn Sinh học có đáp án
- Tổng hợp Dạng bài - Công thức môn Sinh học
- Tổng hợp về các tác giả văn học
- 3000 câu hỏi ôn tập môn Ngữ văn có đáp án
- Tổng hợp kiến thức Ngữ Văn
- Tuyển tập truyện dân gian, truyền thuyết, cổ tích,... Việt Nam
- Tổng hợp các đề đọc - hiểu có đáp án chi tiết
- Trò chơi Powerpoint | Game Powerpoint
- Tổng hợp bài thu hoạch BDTX Giáo viên mầm non (2025) theo Thông tư 12
- Tổng hợp bài thu hoạch BDTX Giáo viên tiểu học (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THCS (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THPT (2025)
