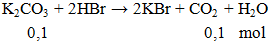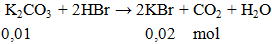K2CO3 + HBr → KBr + CO2 + H2O l K2CO3 ra KBr
K2CO3 + HBr → KBr + CO2 + H2O là phản ứng trao đổi. Bài viết này cung cấp đầy đủ thông tin về phương trình hóa học đã được cân bằng, điều kiện các chất tham gia phản ứng, hiện tượng (nếu có), ... Mời các bạn đón xem:
Phản ứng K2CO3 + HBr → KBr + CO2 + H2O
1. Phản ứng hóa học
K2CO3 + 2HBr → 2KBr + CO2 + H2O
2. Điều kiện phản ứng
Điều kiện thường,
3. Cách thực hiện phản ứng
Nhỏ HBr vào ống nghiệm chứa K2CO3.
4. Hiện tượng nhận biết phản ứng
Có khí không màu thoát ra.
5. Bản chất của các chất tham gia phản ứng
5.1. Bản chất của K2CO3 (Kali cacbonat)
K2CO3 mang đầy đủ tính chất hoá học của muối tác dụng được với các axit mạnh.
5.2. Bản chất của HBr (Axit bromhidric)
HBr là một axit mạnh tác dụng được với muối.
6. Tính chất hóa học của K2CO3
Là một muối của axit cacbonic và một muối yếu nên K2CO3 có tính chất sau:
- Tác dụng với axit mạnh hơn để tạo thành muối mới như CH3COOH, H2SO3, HNO3, HCl ....
-
- K2CO3 + 2CH3COOH → 2CH3COOK + CO2↑ + H2O
- K2CO3 + H2SO4 → K2SO4 + CO2↑ + H2O
– K2CO3 phản ứng với dung dịch kiềm để tạo muối:
-
- K2CO3 + NaOH → Na2CO3 + KOH
– K2CO3 tác dụng với dung dịch muối để tạo muối mới bền vững hơn:
-
- K2CO3 + NaCl → KCl + Na2CO3
– Do là một muối axit yếu nên K2CO3 dễ bị phân hủy ở nhiệt độ cao để giải phóng ra khí cacbonic:
K2CO3 → K2O + CO2
7. Ứng dụng của K2CO3
Kali cacbonat được ứng dụng trong ngành sản xuất chất nổ, phân bón, sốm sứ thủy tinh, xà phòng, nhuộm len,... K2CO3 còn có tác dụng để làm mềm nước cứng. Bên cạnh đó, chúng còn được sử dụng trong ngành sản xuất kính và xà phòng.
8. Tính chất hóa học của HBr
HBr thể hiện tính chất đặc trưng của 1 axit, bao gồm:
- Đổi màu chất chỉ thị: Khi nhỏ 1 ít dung dịch HBr vào chất chỉ thị màu, quỳ tím sẽ chuyển sang màu đỏ.
- Tác dụng với kim loại: Tạo ra muối bromide và giải phóng khí H2.
Chú ý: Không tác dụng được với những kim loại đứng sau nguyên tử H trong dãy hoạt động hoá học kim loại.
2HBr + 2Na → 2NaBr + H2
- Tác dụng với oxit bazơ: Tạo ra muối bromide và nước.
Na2O + 2HBr → 2NaBr + H2O
- Tác dụng với bazơ (Phản ứng trung hoà): Sản phẩm tạo thành là muối và nước
Mg(OH)2 + 2HBr → MgBr2+ 2H2O
- Tác dụng với muối: Sản phẩm tạo thành muối và axit. Để điều kiện phản ứng xảy ra cần thoả mãn điều kiện sau:
+ Muối tham gia vào quá trình phản ứng phải tan được trong nước.
+ Sản phẩm tạo thành phải là muối kết tủa hoặc axit yếu.
K2CO3 + 2HBr → 2KBr + H2O + CO2
AgNO3 + HBr → AgBr(kết tủa) + HNO3
- Tác dụng với nguyên tố phi kim:
Cl2 + 2HBr→ Br2 + 2HCl
9. Câu hỏi vận dụng
Câu 1. Nhỏ HBr vào ống nghiệm chứa K2CO3 thu được hiện tượng là
A. Có khí không màu thoát ra.
B. Có khí màu nâu đỏ thoát ra.
C. Có khí màu vàng lục, mùi xốc thoát ra.
D. Không có hiện tượng gì.
Lời giải:
K2CO3 + 2HBr → 2KBr + CO2 + H2O
CO2: khí không màu,
Đáp án A.
Câu 2. Thể tích khí ở dktc thoát ra khi cho 13,8g K2CO3 phản ứng hoàn toàn với lượng dư HBr là
A. 1,12 lít. B. 2,24 lít. C. 3,36 lít. D. 4,48 lít.
Lời giải:
V = 0,1.22,4 = 2,24 lít.
Đáp án B.
Câu 3. Cho 1,38g K2CO3 phản ứng hoàn toàn với lượng HBr, khối lượng muối có trong dung dịch thu được sau phản ứng là
A. 2,38 gam. B, 0,745 gam. C. 0,475 gam. D. 1,49 gam.
Lời giải:
khối lượng muối = 0,02.119 = 2,38 gam.
Đáp án A.
Xem thêm các phương trình hóa học khác:
K2CO3 + H2SO4 → K2SO4 + CO2 + H2O
Xem thêm các chương trình khác:
- Các dạng bài tập Tiếng Anh thông dụng nhất
- 3000 câu hỏi ôn tập môn Tiếng Anh có đáp án
- Toàn bộ kiến thức về cụm động từ | Định nghĩa và cách dùng
- 500 đoạn văn Tiếng Anh thông dụng nhất và cách làm
- 1000 câu hỏi ôn tập môn Công nghệ có đáp án
- 1000 câu hỏi ôn tập Giáo dục công dân
- 15000 câu hỏi ôn tập môn Toán có đáp án
- Wiki Toán | Khái niệm, định lí, tính chất, dạng bài, công thức
- Tuyển tập đề thi + chuyên đề ôn thi Toán Kangaroo các cấp độ (có đáp án 2024)
- 3000 câu hỏi ôn tập môn Vật lí có đáp án
- Tổng hợp Dạng bài - Công thức môn Vật lí
- 2000 câu hỏi ôn tập môn Tin học có đáp án
- 3000 câu hỏi ôn tập môn Lịch sử có đáp án
- 3000 câu hỏi ôn tập môn Địa lí có đáp án
- 2000 câu hỏi ôn tập môn Sinh học có đáp án
- Tổng hợp Dạng bài - Công thức môn Sinh học
- Tổng hợp về các tác giả văn học
- 3000 câu hỏi ôn tập môn Ngữ văn có đáp án
- Tổng hợp kiến thức Ngữ Văn
- Tuyển tập truyện dân gian, truyền thuyết, cổ tích,... Việt Nam
- Tổng hợp các đề đọc - hiểu có đáp án chi tiết
- Trò chơi Powerpoint | Game Powerpoint
- Tổng hợp bài thu hoạch BDTX Giáo viên mầm non (2025) theo Thông tư 12
- Tổng hợp bài thu hoạch BDTX Giáo viên tiểu học (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THCS (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THPT (2025)