CaCO3 + CO2 + H2O → Ca(HCO3)2 | CaCO3 ra Ca(HCO3)2
CaCO3 + CO2 + H2O → Ca(HCO3)2 là phản ứng hóa hợp. Bài viết này cung cấp đầy đủ thông tin về phương trình hóa học đã được cân bằng, điều kiện các chất tham gia phản ứng, hiện tượng (nếu có), ... Mời các bạn đón xem:
Phản ứng CaCO3 + CO2 + H2O → Ca(HCO3)2
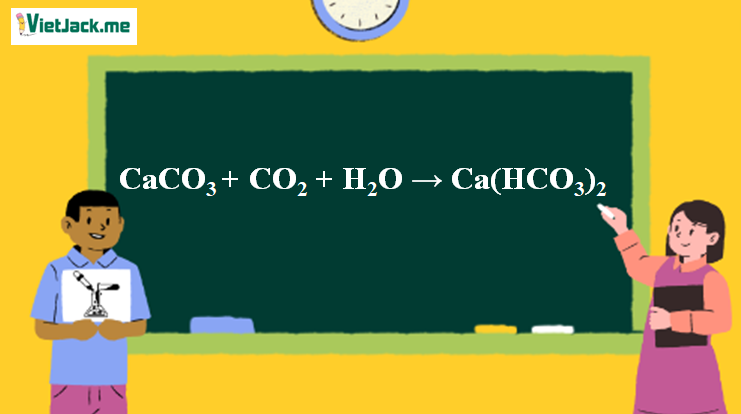
1. Phương trình phản ứng CaCO3 ra Ca(HCO3)2
CaCO3 + CO2 + H2O → Ca(HCO3)2
2. Điều kiện phản ứng CaCO3 tác dụng với CO2
Nhiệt độ thường
3. Bản chất của CaCO3 (Canxi cacbonat) trong phản ứng
CaCO3 là muối cacbonat phản ứng được với nước có hòa tan CO2 để tạo thành Ca(HCO3)2 tan trong nước. (Chú ý: Đây là phản ứng thuận nghịch tạo thạch nhũ trong hang động)
4. Mở rộng kiến thức về CaCO3
4.1. Tính chất vật lí & nhận biết
- Tính chất vật lí: Là chất rắn màu trắng, không tan trong nước.
- Nhận biết: sử dụng dung dịch axit HCl, thấy thoát ra khí không màu, không mùi:
CaCO3 + 2HCl → CaCl2 + H2O + CO2
4.2. Tính chất hóa học
- Mang đầy đủ tính chất hóa học của muối:
Tác dụng với axit mạnh:
CaCO3 + 2HCl → CaCl2 + H2O + CO2
Kém bền với nhiệt:
CaCO3 -to→ CaO + CO2
CaCO3 tan dần trong nước có hòa tan khí CO2.
CaCO3 + CO2 + H2O ⇆ Ca(HCO3)2
→ khi đun nóng:
Ca(HCO3)2 -to→ CaCO3↓ + CO2 + H2O
4.3. Điều chế
Đa số cacbonat canxi được sử dụng trong công nghiệp là được khai thác từ đá mỏ hoặc đá núi. Cacbonat canxi tinh khiết (ví dụ loại dùng làm thuốc hoặc dược phẩm), được điều chế từ nguồn đá mỏ (thường là cẩm thạch) hoặc nó có thể được tạo ra bằng cách cho khí cacbonic qua dung dịch canxi hidroxit.
Ca(OH)2 + CO2 → CaCO3↓ + H2O
4.4. Ứng dụng
+ CaCO3 được xem như là chất phụ gia cho ngành sản xuất sản phẩm thức ăn chăn nuôi cho gia súc. Bên cạnh đó, Canxi cacbonat cũng là nguồn dinh dưỡng cần thiết cho quá trình hình thành trứng và sự phát triển của xương đối với các loại gia cầm.
+ CaCO3 được sử dụng như 1 loại phân bón giúp cây trồng phát triển, ổn định độ pH cho đất, cung cấp chất dinh dưỡng cho cây.
+ Ngoài ra, CaCO3 còn được sử dụng như chất phụ gia cho ngành sản xuất thuốc trừ sâu bởi loại khoáng này khá thân thiện với môi trường.
5. Tính chất hóa học của CO2
CO2 là oxit axit
- CO2 tan trong nước tạo thành axit cacbonic (là một điaxit rất yếu)
CO2 + H2O ↔ H2CO3
- CO2 tác dụng với oxit bazơ → muối.
CaO + CO2 → CaCO3 (t0)
- CO2 tác dụng với dung dịch bazơ → muối + H2O
NaOH + CO2 → NaHCO3
2NaOH + CO2 → Na2CO3 + H2O
- CO2 bền, ở nhiệt độ cao thể hiện tính oxi hóa khi tác dụng với các chất khử mạnh
CO2 + 2Mg → 2MgO + C
CO2 + C → 2CO
Lưu ý: Được dùng để giải thích CO2 không dùng để dập tắt các đám cháy kim loại.
6. Câu hỏi vận dụng
Câu 1. Cho phương trình hóa học sau: CaCO3 + CO2+ H2O ⇌ Ca(HCO3)2
Phương trình hóa học trên là phản ứng
A. tạo thạch nhũ trong hang động
B. tạo macma
C. tạo muối CaCl2
D. tạo kết tủa xanh lam
Lời giải:
Đáp án: A
Câu 2. Quá trình tạo thành thạch nhũ trong các hang động đá vôi kéo dài hàng triệu năm. Quá trình này được giải thích bằng phương trình hóa học nào sau đây ?
A. Ca(HCO3)2 → CaCO3 + CO2 + H2O
B. Mg(HCO3)2 → MgCO3 + CO2 + H2O
C. CaCO3 + CO2 + H2O → Ca(HCO3)2
D. CaCO3 + 2H+ → Ca2+ + CO2 + H2O
Lời giải:
Đáp án: A
Giải thích:
Quá trình tạo thạch nhũ trong hang động là do: Ca(HCO3)2 → CaCO3 + CO2 + H2O.
phản ứng nghịch: CaCO3 + CO2 + H2O → Ca(HCO3)2 giải thích sự xâm thực của nước mưa
Câu 3. Phản ứng hóa học xảy ra trong quá trình tạo thạch nhũ trong các hang động đá vôi là
A. CaCO3 + CO2 + H2O → Ca(HCO3)2
B. Ca(OH)2+ CO2 → CaCO3 + H2O
C. Ca(HCO3)2→ CaCO3+ CO2 + H2O
D. Ca(OH)2 + 2CO2 → Ca(HCO3)2
Lời giải:
Đáp án: C
Câu 4. Dẫn luồng khí CO qua hỗn hợp gồm Fe2O3, CuO, MgO, Al2O3 (nung nóng). Sau khi phản ứng xảy ra hoàn toàn thu được chất rắn là
A. Al2O3, Cu, MgO, Fe.
B. Al, Fe, Cu, Mg.
C. Al2O3, Cu, Mg, Fe.
D. Al2O3, Fe2O3, Cu, MgO.
Lời giải:
Đáp án: A
Xem thêm các phương trình phản ứng hóa học khác:
Xem thêm các chương trình khác:
- Các dạng bài tập Tiếng Anh thông dụng nhất
- 3000 câu hỏi ôn tập môn Tiếng Anh có đáp án
- Toàn bộ kiến thức về cụm động từ | Định nghĩa và cách dùng
- 500 đoạn văn Tiếng Anh thông dụng nhất và cách làm
- 1000 câu hỏi ôn tập môn Công nghệ có đáp án
- 1000 câu hỏi ôn tập Giáo dục công dân
- 15000 câu hỏi ôn tập môn Toán có đáp án
- Wiki Toán | Khái niệm, định lí, tính chất, dạng bài, công thức
- Tuyển tập đề thi + chuyên đề ôn thi Toán Kangaroo các cấp độ (có đáp án 2024)
- 3000 câu hỏi ôn tập môn Vật lí có đáp án
- Tổng hợp Dạng bài - Công thức môn Vật lí
- 2000 câu hỏi ôn tập môn Tin học có đáp án
- 3000 câu hỏi ôn tập môn Lịch sử có đáp án
- 3000 câu hỏi ôn tập môn Địa lí có đáp án
- 2000 câu hỏi ôn tập môn Sinh học có đáp án
- Tổng hợp Dạng bài - Công thức môn Sinh học
- Tổng hợp về các tác giả văn học
- 3000 câu hỏi ôn tập môn Ngữ văn có đáp án
- Tổng hợp kiến thức Ngữ Văn
- Trò chơi Powerpoint | Game Powerpoint
- Tổng hợp bài thu hoạch BDTX Giáo viên mầm non (2024) theo Thông tư 12
- Tổng hợp bài thu hoạch BDTX Giáo viên tiểu học (2024)
- Tổng hợp bài thu hoạch BDTX Giáo viên THCS (2024)
- Tổng hợp bài thu hoạch BDTX Giáo viên THPT (2024)
