CaCO3 + HCl → CaCl2 + CO2 + H2O | CaCO3 ra CaCl2 | HCl ra CaCl2
CaCO3 + HCl → CaCl2 + CO2 + H2O là phản ứng trao đổi. Bài viết này cung cấp đầy đủ thông tin về phương trình hóa học đã được cân bằng, điều kiện các chất tham gia phản ứng, hiện tượng (nếu có), ... Mời các bạn đón xem:
Phản ứng CaCO3 + HCl → CaCl2 + CO2 + H2O
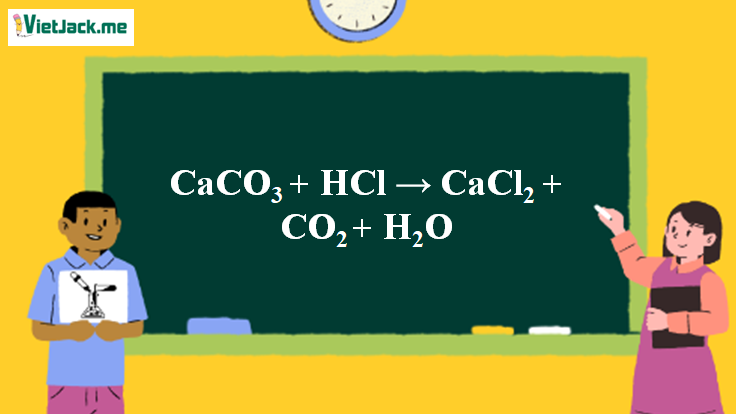
1. Phương trình phản ứng CaCO3 ra CO2
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
2. Điều kiện phản ứng CaCO3 ra CaCl2
Nhiệt độ thường
3. Đá vôi tác dụng với HCl có hiện tượng
Đá vôi tan dần và thấy có khí không màu thoát ra làm dung dịch sủi bọt.
4. Bản chất của các chất tham gia phản ứng
4.1. Bản chất của CaCO3 (Canxi cacbonat)
CaCO3 mang đầy đủ tính chất hoá học của muối tác dụng được với các axit mạnh.
4.2. Bản chất của HCl (Axit clohidric)
HCl là một axit mạnh tác dụng được với muối cacbonat tạo muối mới và nước, đồng thời giải phóng khí cacbonic.
5. Mở rộng kiến thức về CaCO3
5.1. Tính chất vật lí & nhận biết
- Tính chất vật lí: Là chất rắn màu trắng, không tan trong nước.
- Nhận biết: sử dụng dung dịch axit HCl, thấy thoát ra khí không màu, không mùi:
CaCO3 + 2HCl → CaCl2 + H2O + CO2
5.2. Tính chất hóa học
- Mang đầy đủ tính chất hóa học của muối:
Tác dụng với axit mạnh:
CaCO3 + 2HCl → CaCl2 + H2O + CO2
Kém bền với nhiệt:
CaCO3 -to→ CaO + CO2
CaCO3 tan dần trong nước có hòa tan khí CO2.
CaCO3 + CO2 + H2O ⇆ Ca(HCO3)2
→ khi đun nóng:
Ca(HCO3)2 -to→ CaCO3↓ + CO2 + H2O
5.3. Điều chế
Đa số cacbonat canxi được sử dụng trong công nghiệp là được khai thác từ đá mỏ hoặc đá núi. Cacbonat canxi tinh khiết (ví dụ loại dùng làm thuốc hoặc dược phẩm), được điều chế từ nguồn đá mỏ (thường là cẩm thạch) hoặc nó có thể được tạo ra bằng cách cho khí cacbonic qua dung dịch canxi hidroxit.
Ca(OH)2 + CO2 → CaCO3↓ + H2O
5.4. Ứng dụng
+ CaCO3 được xem như là chất phụ gia cho ngành sản xuất sản phẩm thức ăn chăn nuôi cho gia súc. Bên cạnh đó, Canxi cacbonat cũng là nguồn dinh dưỡng cần thiết cho quá trình hình thành trứng và sự phát triển của xương đối với các loại gia cầm.
+ CaCO3 được sử dụng như 1 loại phân bón giúp cây trồng phát triển, ổn định độ pH cho đất, cung cấp chất dinh dưỡng cho cây.
+ Ngoài ra, CaCO3 còn được sử dụng như chất phụ gia cho ngành sản xuất thuốc trừ sâu bởi loại khoáng này khá thân thiện với môi trường.
6. Tính chất hóa học của HCl
Dung dịch axit HCl có đầy đủ tính chất hoá học của một axit mạnh.
6.1. Tác dụng chất chỉ thị
Dung dịch HCl làm quì tím hoá đỏ (nhận biết axit)
HCl → H+ + Cl-
6.2. Tác dụng với kim loại
Tác dụng với KL (đứng trước H trong dãy Bêkêtôp) tạo muối (với hóa trị thấp của kim loại) và giải phóng khí hidrô (thể hiện tính oxi hóa)
Fe + 2HCl 
2Al + 6HCl 
Cu + HCl → không có phản ứng
6.3. Tác dụng với oxit bazo và bazo
Sản phẩm tạo muối và nước
NaOH + HCl → NaCl + H2 O
CuO + 2HCl 
Fe2 O3 + 6HCl
6.4. Tác dụng với muối (theo điều kiện phản ứng trao đổi)
CaCO3 + 2HCl → CaCl2 + H2O + CO2↑
AgNO3 + HCl → AgCl↓ + HNO3
(dùng để nhận biết gốc clorua )
Ngoài tính chất đặc trưng là axit , dung dịch axit HCl đặc còn thể hiện vai trò chất khử khi tác dụng chất oxi hoá mạnh như KMnO4, MnO2, K2 Cr2O7, MnO2, KClO3 ……
4HCl + MnO2 
K2 Cr2 O7 + 14HCl → 3Cl2 + 2KCl + 2CrCl3 + 7H2 O
Hỗn hợp 3 thể tích HCl và 1 thể tích HNO3 đặc được gọi là hỗn hợp nước cường toan ( cường thuỷ) có khả năng hoà tan được Au ( vàng)
3HCl + HNO3 → 2Cl + NOCl + 2H2O
NOCl → NO + Cl
Au + 3Cl → AuCl3
7. Bài tập vận dụng
Câu 1. Cặp chất nào sau đây có thể tồn tại trong cùng một dung dịch
A. KCl và NaOH
B. AgNO3và NaCl
C. Ba(OH)2 và NaOH
D. CaCO3 và HCl
Lời giải:
Đáp án: A
Câu 2. Phản ứng nào sau đây sau phản ứng thu được chất khí
A. KCl + AgNO3
B. CaCO3+ HCl
C. NaOH + H2SO4
D. BaCl2 + Na2SO4
Lời giải:
Đáp án: B
Giải thích:
Phương trình phản ứng hóa học
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
Câu 3. Dãy muối cacbonat bị nhiệt phân ở nhiệt độ cao
A. K2CO3, Ba(HCO3)2.
B. Na2CO3, KHCO3.
C. CaCO3, Ca(HCO3)2.
D. MgCO3, K2CO3.
Lời giải:
Đáp án: C
Giải thích:
Na2CO3 và K2CO3 không bị nhiệt phân hủy
=> loại A, B, D => Chọn C
CaCO3 → CaO + CO2↑
Ca(HCO3)2 → CaCO3 + CO2 + H2O
Câu 4. Cho 10 gam CaCO3 vào dung dịch HCl dư thể tích CO2 thu được ở đktc là:
A. 11,2 lít
B. 1,12 lít
C. 2,24 lít
D. 22,4 lít
Lời giải:
Đáp án: C
Giải thích:
Số mol CaCO3 = 10 : 100 = 0,1 mol
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
0,1 0,1
→ Vkhí = n.22,4 = 0,1.22,4 = 2,24 lít.
Câu 5. Cho dung dịch NaOH vào ống nghiệm đựng dung dịch FeCl3, hiện tượng quan sát được là:
A. Có kết tủa trắng xanh.
B. Có khí thoát ra.
C. Có kết tủa đỏ nâu.
D. Kết tủa màu trắng.
Lời giải:
Đáp án: C
Giải thích:
3NaOH + FeCl3 → 3NaCl + Fe(OH)3 (↓ đỏ nâu)
Câu 6. Thổi V lít khí CO2 (đktc) vào 100ml dd Ca(OH)2 1M thu được 6g kết tủa. Lọc kết tủa đun nóng dung dịch lại thấy có kết tủa nữa. Tìm V?
A. 3,136 lít
B. 6,272 lít
C. 2,240 lít
D. 3,360 lít
Lời giải:
Đáp án: A
Giải thích:
nCaCO3 =6/100 = 0,06 mol
Do đun nóng lại thu được thêm kết tủa => nên có Ca(HCO3)2
nCaCO3 tạo thêm là 4/100 = 0,04 mol
CO2 + Ca(OH)2 → CaCO3 + H2O
0,06 0,06 0,06
2CO2 + Ca(OH)2 → Ca(HCO3)2
Ca(HCO3)2 → CaCO3 + CO2 + H2O
0,04 0,04
→ nCO2 ở phản ứng 2 là 0,04.2 =0 ,08 mol
→ nCO2= 0,06 + 0,08 = 0,14 mol
→ V = 0,14.22,4 = 3,136 lít
Câu 7. Cho 18,25 gam muối hiđrocacbon phản ứng hết với dung dịch H2SO4 (dư), thu được dung dịch chứa 15 gam muối sunfat trung hòa. Công thức của muối hiđrocacbon là:
A. KHCO3
B. Mg(HCO3)2
C. NaHCO3
D. Ca(HCO3)2
Lời giải:
Đáp án: B
Giải thích:
Gọi công thức muối hiđrocacbonat: M(HCO3)n
Phương trình hóa học tổng quát:
2M(HCO3)n + nH2SO4 → M2(SO4)n + 2nCO2 + 2nH2O
2 mol 1 mol
Số mol muối hidrocacbonat là: 18,25/(M+61n)
Số mol muối trung hòa tạo thành là: 15/(2M + 96n)
Theo phương trình hóa học ta có: 18,25/(M+61n) = 2. 15/(2M + 96n)
Biến đổi ta được phương trình 3,25M = 39n
Cặp nghiệm phù hợp là: n = 2 và M = 24 (Mg)
Công thức của muối hiđrocacbonat là Mg(HCO3)2.
Câu 8. Nhỏ từ từ từng giọt đến hết 60 ml dung dịch HCl 1M vào 200 ml dung dịch chứa Na2CO3 0,2M và NaOH 0,2M , sau phản ứng thu được số mol CO2 là:
A. 0,03
B. 0,01
C. 0,02
D. 0,015
Lời giải:
Đáp án: C
nHCl = 0,06 (mol)
nNa2CO3 = 0,1.0,2 = 0,04 (mol);
nNaHCO3 = 0,1.0,2 = 0,04 (mol)
Khi nhỏ từ từ H+ vào dd hỗn hợp CO32- và HCO3- xảy ra phản ứng:
H+ + CO32- → HCO3- (1)
H+ + HCO3- → CO2 + H2O (2)
=> nCO2(2) = ∑nH+ - nCO32- = 0,06 – 0,04 = 0,02 (mol)
Câu 9. Dẫn V lít (đktc) khí CO2 qua 200ml dung dịch Ca(OH)2 1M thu được 12 gam kết tủa. Lọc bỏ kết tủa, lấy dung dịch nước lọc đun nóng lại thu được kết tủa nữa. Giá trị của V là:
A. 1,344 lít.
B. 6,272 lít.
C. 3,136 lít.
D. 3,136 lít hoặc 6,272 lít.
Lời giải:
Đáp án: B
Giải thích:
Dung dịch sau phản ứng khi đun nóng có tạo thêm kết tủa => có tạo ra HCO3-
nCa(OH)2 = 0,2 mol;
nCaCO3 = 12/100 = 0,12 mol
Bảo toàn nguyên tố Ca:
nCa(OH)2 = nCaCO3 + nCa(HCO3)2
=> nCa(HCO3)2 = 0,2 – 0,12 = 0,08 mol
=> Bảo toànnguyên tố C: nCO2 = nCaCO3 + 2nCa(HCO3)2= 0,12 + 0,08.2 = 0,28 mol
=> VCO2 = 0,28.22,4 = 6,272 lít
Câu 10. Cho 9,125 gam muối hiđrocacbon phản ứng hết với dung dịch H2SO4 (dư), thu được dung dịch chứa 7,5 gam muối sunfat trung hòa. Công thức của muối hiđrocacbon là:
A. NaHCO3
B. Mg(HCO3)2
C. Ba(HCO3)2
D. Ca(HCO3)2
Lời giải:
Đáp án: B
Giải thích:
Gọi công thức muối hiđrocacbonat: M(HCO3)n
Phương trình: 2M(HCO3)n + nH2SO4 → M2(SO4)n + 2nCO2 + 2nH2O
Ta thấy:
2 mol M(HCO3)n → 1 mol M2(SO4)n thì khối lượng giảm:
2,61n - 96n = 26n (g)
Vậy x mol M(HCO3)n → M2(SO4)n thì khối lượng giảm:
9,125 - 7,5 = 1,625 (g)
=> x = (1,625.2)/26n = 0,125/n (mol) => M + 61n = (9,125/0,125/n) = 73n => M = 12n
Cặp nghiệm phù hợp là: n = 2 và M = 24 (Mg)
Công thức của muối hiđrocacbonat là Mg(HCO3)2.
Xem thêm các phương trình phản ứng hóa học khác:
CaCO3 + HNO3 → Ca(NO3)2 + CO2 + H2O
Xem thêm các chương trình khác:
- Các dạng bài tập Tiếng Anh thông dụng nhất
- 3000 câu hỏi ôn tập môn Tiếng Anh có đáp án
- Toàn bộ kiến thức về cụm động từ | Định nghĩa và cách dùng
- 500 đoạn văn Tiếng Anh thông dụng nhất và cách làm
- 1000 câu hỏi ôn tập môn Công nghệ có đáp án
- 1000 câu hỏi ôn tập Giáo dục công dân
- 15000 câu hỏi ôn tập môn Toán có đáp án
- Wiki Toán | Khái niệm, định lí, tính chất, dạng bài, công thức
- Tuyển tập đề thi + chuyên đề ôn thi Toán Kangaroo các cấp độ (có đáp án 2025)
- 3000 câu hỏi ôn tập môn Vật lí có đáp án
- Tổng hợp Dạng bài - Công thức môn Vật lí
- 2000 câu hỏi ôn tập môn Tin học có đáp án
- 3000 câu hỏi ôn tập môn Lịch sử có đáp án
- 3000 câu hỏi ôn tập môn Địa lí có đáp án
- 2000 câu hỏi ôn tập môn Sinh học có đáp án
- Tổng hợp Dạng bài - Công thức môn Sinh học
- Tổng hợp về các tác giả văn học
- 3000 câu hỏi ôn tập môn Ngữ văn có đáp án
- Tổng hợp kiến thức Ngữ Văn
- Tuyển tập truyện dân gian, truyền thuyết, cổ tích,... Việt Nam
- Tổng hợp các đề đọc - hiểu có đáp án chi tiết
- Trò chơi Powerpoint | Game Powerpoint
- Tổng hợp bài thu hoạch BDTX Giáo viên mầm non (2025) theo Thông tư 12
- Tổng hợp bài thu hoạch BDTX Giáo viên tiểu học (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THCS (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THPT (2025)
- Tổng hợp thông tin, kiến thức chung
- Tiền tiểu học
