Mg + H2SO4 đặc, nóng → MgSO4 + SO2 + H2O | Mg ra SO2
Mg + H2SO4 đặc, nóng → MgSO4 + SO2 + H2O là phản ứng oxi hóa - khử. Bài viết này cung cấp đầy đủ thông tin về phương trình hóa học đã được cân bằng, điều kiện các chất tham gia phản ứng, hiện tượng (nếu có), ... Mời các bạn đón xem:
Phản ứng: Mg + H2SO4 đặc, nóng → MgSO4 + SO2 + H2O
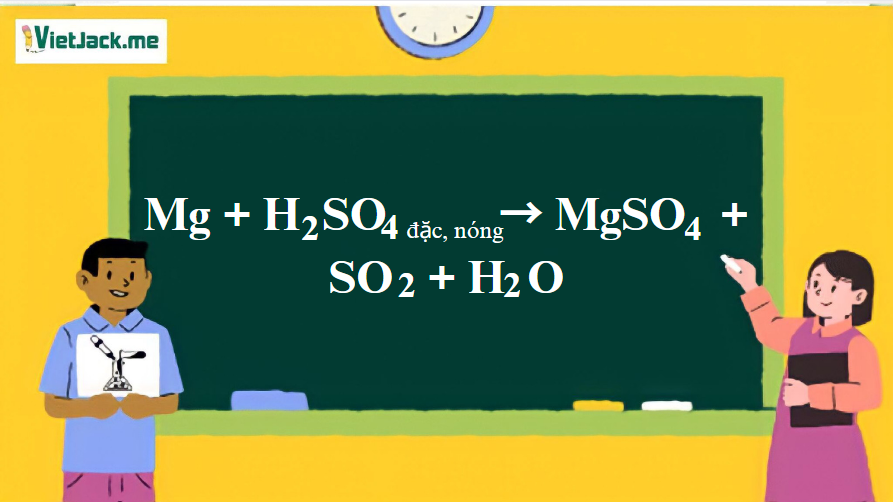
1. Phương trình ứng Mg tác dụng với H2SO4 đặc, nóng
Mg + 2H2SO4 → MgSO4 + SO2 + 2H2O
2. Điều kiện phản ứng Mg tác dụng với H2SO4 đặc, nóng ra SO2
H2SO4 đặc, nóng
3. Cách cân bằng phản ứng Mg tác dụng với H2SO4 đặc, nóng ra SO2
Phản ứng hoá học được cân bằng:
Mg + 2H2SO4 → MgSO4 + SO2 + 2H2O
4. Hiện tượng sau phản ứng
Mẩu magie tan dần, xuất hiện khí không màu, có mùi hắc chính là lưu huỳnh đioxit (SO2).
5. Tính chất hóa học của Mg
Magie là chất khử mạnh.
M → M2+ + 2e
5.1. Tác dụng với phi kim
Ví dụ:
2Mg + O2 → 2MgO
Trong không khí, Mg bị oxi hoá chậm tạo thành màng oxit mỏng bào vệ kim loại, khi đốt nóng chúng bị cháy trong oxi.
Mg + Cl2 " MgCl2
Lưu ý:
2Mg + CO2 → 2MgO + C
Vì vậy không dùng tuyết cacbonic để dập tắt đám cháy Mg.
5.2. Tác dụng với axit
Với dung dịch HCl và H2SO4 loãng:
Mg + H2SO4 → MgSO4 + H2
Mg +2HCl → MgCl2 + H2
Với dung dịch HNO3; H2SO4 đặc:
Mg có thể khử thành các hợp chất có mức oxi hoá thấp hơn.
Ví dụ:
Mg + 4HNO3 đặc Mg(NO3)2 + 2NO2 + 2H2O
4Mg + 5H2SO4 đặc 4MgSO4 + H2S + 4H2O
5.3. Tác dụng với nước
Ở nhiệt độ thường, Mg hầu như không tác dụng với nước. Mg phản ứng chậm với nước nóng (do tạo thành hidroxit khó tan).
Mg + 2H2O → Mg(OH)2 + H2
Lưu ý: Magie cháy trong hơi nước thu được MgO và hidro.
Mg + H2O → MgO + H2
6. Tính chất hóa học của H2SO4 đặc
Trong H2SO4 thì S có mức oxi hóa +6 cao nhất nên H2SO4 đặc có tính axit mạnh, oxi hóa mạnh và có tính háo nước.
Có những tính chất hóa học riêng
6.1 Axit sunfuric đặc tác dụng với kim loại trừ (Au, Pt)
Axit sunfuric tác dụng với kim loại tạo muối và nhiều sản phẩm oxi hóa khác nhau như SO2, H2S, S.
Ví dụ:
Cu + H2SO4 → CuSO4 + SO2 + H2O
Fe + H2SO4 → Fe2(SO4)3 + SO2 + H2O
Fe, Al, Cr bị thụ động hóa trong dung dịch HNO3 đặc, nguội
6.2 Tính háo nước của axit sunfuric đặc
C12H22O11 11H2O + 12C
3. Axit sunfuric đặc tác dụng với phi kim
C + 2H2SO4 đặc nóng → CO2 + 2SO2 + 2H2O
S + 2H2SO4 đặc nóng → 3SO2 + 2H2O
6.3 Axit sunfuric đặc tác dụng với các chất khử khác
H2SO4 đặc nóng + 8HI → H2S + 4I2 + 4H2O
7. Tính chất vật lí của H2SO4
- H2SO4 đặc hay lỏng đều có điểm chung tồn tại dưới dạng chất lỏng, không màu, không mùi và không vị.
- H2SO4 đặc nổi bật với khả năng hút nước rất mạnh và tỏa nhiều nhiệt. Vì vậy bạn chú ý không nên cho nước vào axit mà chỉ được phép cho axit vào nước. Để đánh trường hợp bị bỏng xảy ra khi nước tác dụng với axit. Và H2SO4 còn có thể pha loãng ra để trở thành H2SO4 lỏng. Nhưng bạn nhớ thực hiện đúng quy trình ở trên để không gặp những tình trạng nguy hiểm.
8. Bài tập vận dụng liên quan
Câu 1. Cho dãy các chất sau: NaOH, CuCl2, H2SO4, Ba(OH)2. Số chất tác dụng với Mg tạo khí là
A. 2
B. 3
C. 4
D. 1
Hướng dẫn giải
Đáp án D
Mg tác dụng được với H2SO4 sinh ra khí.
Câu 2. Dãy kim loại nào sau đây phản ứng được H2SO4 loãng?
A. Zn, Cu, Fe
B. Mg, Fe, Cu
C. Al, Zn, Mg
D. Cu, Fe, Mg
Hướng dẫn giải
Đáp án C
Dãy kim loại phản ứng được H2SO4 loãng là những kim loại mạnh đứng trước hidro trong dãy hoạt động hóa học
Phương trình phản ứng minh họa xảy ra
2Al + 3H2SO4 loãng → Al2(SO4)3+ 3H2
Zn + H2SO4 loãng → ZnSO4 + H2
Mg + H2SO4 loãng → MgSO4 + H2
Câu 3. Khi cho magie tác dụng với dung dịch kiềm có hiện tượng gì xảy ra:
A. Kết tủa trắng
B. Có bọt khí thoát ra
C. Kết tủa có màu nâu đỏ
D. Không có hiện tượng gì
Hướng dẫn giải
Đáp án D
Mg không tác dụng với dung dịch kiềm.
Câu 4. Hiện tượng quan sát được khi cho từ từ đến dư dung dịch KOH vào dung dịch MgCl2 là:
A. Xuất hiện kết tủa trắng
B. Xuất hiện kết tủa keo trắng, sau đó kết tủa tan dần đến hết, dung dịch thu được trong suốt
C. Không có hiện tượng gì xảy ra
D. Xuất hiện kết tủa keo trắng, sau đó kết tủa tan dần đến hết, dung dịch thu được màu xanh lam
Hướng dẫn giải
Đáp án A
Hiện tượng: Xuất hiện kết tủa trắng.
Phương trình hoá học: MgCl2 + 2KOH → Mg(OH)2↓ + 2KCl
Câu 5. Nhận định nào sau đây là đúng về kim loại kiềm thổ:
A. Bari là nguyên tố có tính khử mạnh nhất trong dãy kim loại kiềm thổ
B. Tất cả các kim loại kiềm thổ đều tan trong nước ở nhiệt độ thường
C. Kim loại kiềm thổ có tính khử mạnh hơn kim loại kiềm
D. Tính khử của các kim loại kiềm thổ tăng dần từ Be đến Ba.
Hướng dẫn giải
Đáp án D
Mg và Be không phản ứng với nước ở điều kiện thường B sai.
Đi từ đầu nhóm IIA đến cuối nhóm theo chiều tăng dần điện tính hạt nhân tính kim loại (tính khử) tăng dần => Kim loại mạnh nhất là Ra; yếu nhất là Be. => A sai, D đúng.
Nhóm Kim loại kiềm có tính khử mạnh nhất => C sai.
Câu 6. Nhận định nào sau đây không đúng về kim loại nhóm IIA?
A. Đều có cùng một kiểu mạng tinh thể.
B. Ca, Sr, Ba đều tác dụng mạnh với nước ở nhiệt độ thường.
C. Trong các hợp chất thường có số oxi hoá +2.
D. Tính kim loại của các nguyên tố tăng dần theo chiều tăng của điện tích hạt nhân
Hướng dẫn giải
Đáp án A
Câu 7. Câu không đúng đối với tất cả các kim loại nhóm IIA là?
A. các kim loại nhóm IIA có nhiệt độ sôi, nhiêt độ nóng chảy biến đổi không theo qui luật nhất định
B. các kim loại nhóm IIA đều là kim loại có nhiệt độ sôi, nhiệt độ nóng chảy tương đối thấp (trừ Be)
C. các kim loại nhóm IIA đều là kim loại nhẹ
D. các kim loại nhóm IIA đều là kim loại có độ cứng lớn
Hướng dẫn giải
Đáp án D
Câu 8. Cho dãy các chất: FeCl2, MgSO4, BaCl2, KNO3. Số chất trong dãy phản ứng được với dung dịch NaOH là:
A. 1
B. 4
C. 2
D. 3
Hướng dẫn giải
Đáp án C
Các chất trong dãy phản ứng được với dung dịch NaOH là FeCl2, CuSO4 (có 2 chất):
Phương trình phản ứng minh họa xảy ra
2NaOH + FeCl2 → Fe(OH)2 ↓ + 2NaCl
2NaOH + MgSO4 → Mg(OH)2 ↓ + Na2SO4
Câu 9. Khi cho từ từ dung dịch HCl vào dung dịch Na2CO3 khuấy đều, hiện tượng xảy ra là
A. xuất hiện chất khí bay ra ngay khi cho HCl vào
B. sau 1 thời gian thấy xuất hiện chất khí bay ra, dung dịch trong suốt
C. không có khí thoát ra
D. có khí thoát ra và xuất hiện kết tủa
Hướng dẫn giải
Đáp án B
Khi cho từ từ dung dịch HCl vào dung dịch Na2CO3 khuấy đều, hiện tượng xảy ra là sau 1 thời gian thấy xuất hiện chất khí bay ra, dung dịch trong suốt
Phương trình phản ứng minh họa xảy ra
Na2CO3 + HCl → NaCl + NaHCO3
NaHCO3 + HCl → NaCl + CO2+ H2O
Câu 10. NaCl có lẫn tạp chất NaHCO3. Cách nào sau đây có thể dùng để thu được NaCl tinh khiết?
A. Cho hỗn hợp đó vào dung dịch HCl dư, sau đó cô cạn dung dịch
B. Nung hỗn hợp ở nhiệt độ cao
C. Cho hỗn hợp vào nước sau đó hạ nhiệt độ, lọc bỏ kết tủa sau đó cô cạn
D. Cả A và B đều đúng
Hướng dẫn giải
Đáp án A
Để thu được NaCl tinh khiết, ta cho hỗn hợp đó vào dung dịch HCl dư, sau đó cô cạn dung dịch.
Phương trình phản ứng minh họa xảy ra
NaHCO3 + HCl → NaCl + CO2 + H2O
B sai vì nung hỗn hợp thì NaHCO3 chuyển thành Na2CO3 lẫn với NaCl => không thu được NaCl tinh khiết.
C sai vì cả 2 chất đều tan trong nước và khi hạ nhiệt độ không sinh ra kết tủa.
Câu 11. Cho m gam Mg tác dụng hoàn toàn với dung dịch H2SO4 loãng dư thu được 2,24 lit khí H2 (đktc). Giá trị m là
A. 7,2 gam
B. 4,8 gam
C. 2,4 gam
D. 3,6 gam
Hướng dẫn giải
Đáp án C
= 0,1 (mol)
Phương trình hóa học
Mg + 2HCl → MgCl2 + H2↑
(mol) 0,1 ← 0,1
Theo phương trình hóa học:
nMg = = 0,1 (mol)
→ m = mMg = 0,1.24 = 2,4 (g)
Câu 12: Cho 2,4 gam Mg vào dung dịch HCl dư đến khi các phản ứng xảy ra hoàn toàn, thu được V lít H2 (ở đktc). Giá trị của V là
A. 2,24 lít. B. 6,72 lít. C. 3,36 lít. D. 4,48 lít.
Hướng dẫn giải
Đáp án A
Bảo toàn electron:
2 = 2nMg
→ = nMg = 0,1 mol
V = 2,24 lít
Xem thêm các chương trình khác:
- Các dạng bài tập Tiếng Anh thông dụng nhất
- 3000 câu hỏi ôn tập môn Tiếng Anh có đáp án
- Toàn bộ kiến thức về cụm động từ | Định nghĩa và cách dùng
- 500 đoạn văn Tiếng Anh thông dụng nhất và cách làm
- 1000 câu hỏi ôn tập môn Công nghệ có đáp án
- 1000 câu hỏi ôn tập Giáo dục công dân
- 15000 câu hỏi ôn tập môn Toán có đáp án
- Wiki Toán | Khái niệm, định lí, tính chất, dạng bài, công thức
- Tuyển tập đề thi + chuyên đề ôn thi Toán Kangaroo các cấp độ (có đáp án 2024)
- 3000 câu hỏi ôn tập môn Vật lí có đáp án
- Tổng hợp Dạng bài - Công thức môn Vật lí
- 2000 câu hỏi ôn tập môn Tin học có đáp án
- 3000 câu hỏi ôn tập môn Lịch sử có đáp án
- 3000 câu hỏi ôn tập môn Địa lí có đáp án
- 2000 câu hỏi ôn tập môn Sinh học có đáp án
- Tổng hợp Dạng bài - Công thức môn Sinh học
- Tổng hợp về các tác giả văn học
- 3000 câu hỏi ôn tập môn Ngữ văn có đáp án
- Tổng hợp kiến thức Ngữ Văn
- Tuyển tập truyện dân gian, truyền thuyết, cổ tích,... Việt Nam
- Trò chơi Powerpoint | Game Powerpoint
- Tổng hợp bài thu hoạch BDTX Giáo viên mầm non (2025) theo Thông tư 12
- Tổng hợp bài thu hoạch BDTX Giáo viên tiểu học (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THCS (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THPT (2025)
