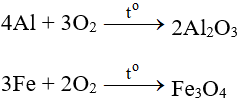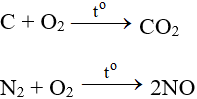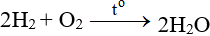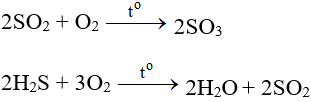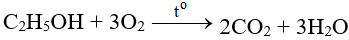Ag2S + O2 → Ag + SO2 | Ag2S ra Ag
Ag2S + O2 → Ag + SO2 là phản ứng oxi hóa khử. Bài viết này cung cấp đầy đủ thông tin về phương trình hóa học đã được cân bằng, điều kiện các chất tham gia phản ứng, hiện tượng (nếu có), ... Mời các bạn đón xem:
Phản ứng Ag2S + O2 → Ag + SO2
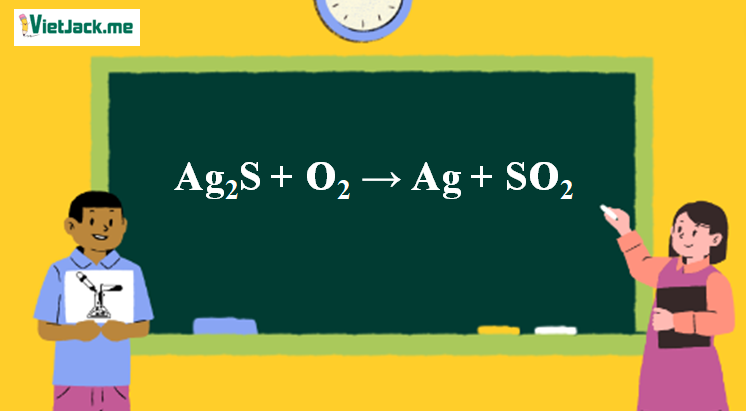
1. Phương trình phản ứng đốt Ag2S trong O2 dư
Ag2S + O2 Ag + SO2
2. Điều kiện phản ứng xảy ra
Nhiệt độ
3. Phương pháp điều chế Ag từ Ag2S
Ag2S là muối không tan, do vậy dùng HNO3 đặc để chuyển về muối tan AgNO3
Ag2S + 10HNO3→ 2AgNO3 + H2SO4+ 8NO2 + 4H2O
Tiếp tục dùng Zn để khử Ag+ về Ag
2AgNO3 + Zn → Zn(NO3)2 + 2Ag↓
4. Phương pháp nhiệt luyện
Dùng chất khử thích hợp như CO, C, Al, H2 khử ion kim loại trong oxit của chúng ở nhiệt độ cao.
5. Tính chất hóa học của O2
- Khi tham gia phản ứng, nguyên tử O dễ dàng nhận thêm 2e. Nguyên tử oxi có độ âm điện lớn (3,44), chỉ kém flo (3,98).
- Do vậy, oxi là nguyên tố phi kim hoạt động hoá học, có tính oxi hoá mạnh. Trong các hợp chất (trừ hợp chất với flo), nguyên tố oxi có số oxi hoá là -2.
- Oxi tác dụng với hầu hết các kim loại (trừ Au, Pt, ...) và các phi kim (trừ halogen). Oxi tác dụng với nhiều hợp chất vô cơ và hữu cơ.
5.1. Tác dụng với kim loại
Tác dụng với hầu hết kim loại (trừ Au và Pt), cần có to tạo oxit:
5.2. Tác dụng với phi kim
Tác dụng với hầu hết phi kim (trừ halogen), cần có to tạo oxit:
ĐB: Tác dụng với H2 nổ mạnh theo tỉ lệ 2:1 về số mol:
5.3. Tác dụng với hợp chất
- Tác dụng với các chất có tính khử:
- Tác dụng với các chất hữu cơ:
6. Tính chất của Ag2S
6.1. Tính chất hóa học
- Phản ứng khử
Ag2S có thể được khử thành bạc kim loại bằng cách tắm các mảnh màu đen bằng nước nóng, NaOH, nhôm và muối. Phản ứng sau đây diễn ra:
Ag2S (s) + 2Al (s) + 3H2O (l) → 6Ag (s) + 3H2S (ac) + Al2O3(s)
+ Nhiệt phân Ag2S ở nhiệt độ cao
Ag2S → 2Ag + S
+ Nghiền nhỏ quặng bạc sunfua Ag2S, xử lí bằng dung dịch natri xianua, rồi lọc để thu được dung dịch muối phức bạc. Phản ứng tương tự cũng sảy ra với KCN.
Ag2S + 4NaCN → Na2S + 2Na[Ag(CN)2]
Trường hợp có H2O tham gia phản ứng
H2O + Ag2S + 4NaCN → NaOH + NaSH + 2Na[Ag(CN)2]
- Đốt bạc sunfua sản phẩm tạo thành là bạc và khí SO2
O2 + Ag2S → 2Ag + SO2
6.2. Điều chế
Cho khí H2S tác dụng với bạc nitrat
2AgNO3 + H2S⟶2HNO3 + Ag2S
Hiện tượng: Xuất hiện kết tủa đen Ag2S.
6.3. Ứng dụng
Các ion bạc có đặc tính kháng khuẩn, nhưng không có nhiều công dụng của hợp chất bạc sunfua. Bạc sunfua được sử dụng trong nghiên cứu và trong các cảm biến màng trong dược phẩm, nhưng không có nhiều công dụng khác của hợp chất này. Sự thật thú vị Nó là một thành phần của phân tích vô cơ chất lượng cổ điển. Khi hình thành trên các tiếp điểm điện hoạt động trong bầu khí quyển giàu hydro sunfua, các sợi dài có thể được gọi là râu bạc có thể hình thành. Khi phá các rương kho báu gỗ trên những con thuyền lớn bị chìm có thể cung cấp sunfua cần thiết để tạo ra khí hydro sunfua. Khi kết hợp với bạc, khí hydro sunfua tạo ra một lớp bạc sunfua patina màu đen trên bạc, để bảo vệ lớp bạc bên trong.
6. Bài tập vận dụng liên quan
Câu 1. Cho các thí nghiệm sau:
(a) Đốt cháy Ag2S trong không khí.
(b) Điện phân dung dịch CuSO4 bằng điện cực trơ.
(c) Cho mẩu Na vào dung dịch CuSO4.
(d) Cho dung dịch NaI vào dung dịch FeCl3.
(e) Nhiệt phân FeCO3.
(g) Điện phân Al2O3 nóng chảy.
Số thí nghiệm tạo ra đơn chất là:
A. 6.
B. 3.
C. 5.
D. 4.
Lời giải:
Câu 2. Dãy gồm các kim loại đều có thể điều chế được bằng phương pháp nhiệt luyện là
A. Fe, Cu, Ag.
B. Fe, Cu, Ba.
C. Na, Fe, Cu.
D. Ca, Al, Fe.
Lời giải:
Câu 3. Những kim loại nào sau đây có thể được điều chế từ oxít bằng phương pháp nhiệt luyện nhờ chất khử CO?
A. Al, Mg, Fe
B. Ni, Cu, Ca
C. Fe, Ni, Zn
D. Fe, Al, Cu
Lời giải:
Xem thêm các phương trình hóa học khác:
Xem thêm các chương trình khác:
- Các dạng bài tập Tiếng Anh thông dụng nhất
- 3000 câu hỏi ôn tập môn Tiếng Anh có đáp án
- Toàn bộ kiến thức về cụm động từ | Định nghĩa và cách dùng
- 500 đoạn văn Tiếng Anh thông dụng nhất và cách làm
- 1000 câu hỏi ôn tập môn Công nghệ có đáp án
- 1000 câu hỏi ôn tập Giáo dục công dân
- 15000 câu hỏi ôn tập môn Toán có đáp án
- Wiki Toán | Khái niệm, định lí, tính chất, dạng bài, công thức
- Tuyển tập đề thi + chuyên đề ôn thi Toán Kangaroo các cấp độ (có đáp án 2024)
- 3000 câu hỏi ôn tập môn Vật lí có đáp án
- Tổng hợp Dạng bài - Công thức môn Vật lí
- 2000 câu hỏi ôn tập môn Tin học có đáp án
- 3000 câu hỏi ôn tập môn Lịch sử có đáp án
- 3000 câu hỏi ôn tập môn Địa lí có đáp án
- 2000 câu hỏi ôn tập môn Sinh học có đáp án
- Tổng hợp Dạng bài - Công thức môn Sinh học
- Tổng hợp về các tác giả văn học
- 3000 câu hỏi ôn tập môn Ngữ văn có đáp án
- Tổng hợp kiến thức Ngữ Văn
- Tuyển tập truyện dân gian, truyền thuyết, cổ tích,... Việt Nam
- Tổng hợp các đề đọc - hiểu có đáp án chi tiết
- Trò chơi Powerpoint | Game Powerpoint
- Tổng hợp bài thu hoạch BDTX Giáo viên mầm non (2025) theo Thông tư 12
- Tổng hợp bài thu hoạch BDTX Giáo viên tiểu học (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THCS (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THPT (2025)