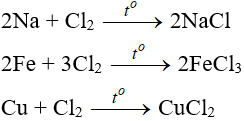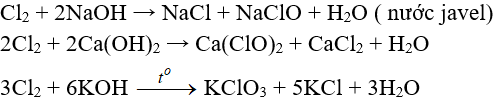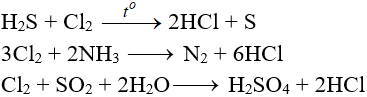H2S + Cl2 + H2O → H2SO4 + HCl | H2S ra H2SO4 | Cl2 ra H2SO4 | Cl2 ra HCl
H2S + Cl2 + H2O → H2SO4 + HCl là phản ứng oxi hóa khử. Bài viết này cung cấp đầy đủ thông tin về phương trình hóa học đã được cân bằng, điều kiện các chất tham gia phản ứng, hiện tượng (nếu có), ... Mời các bạn đón xem:
Phản ứng H2S + Cl2 + H2O → H2SO4 + HCl
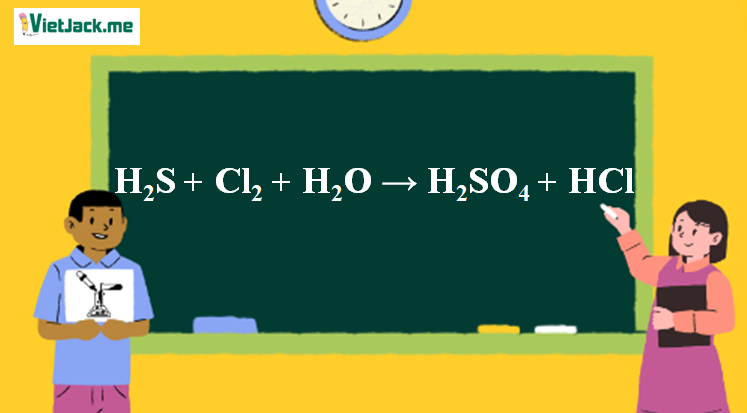
1. Phương trình phản ứng H2S tạo ra H2SO4
H2S + 4Cl2 + 4H2O → H2SO4 + 8HCl
S-2 → S+6 + 8e
→ S-2 nhường e → chất khử.
Cl2 + 2e → 2Cl-.
→ Cl2 nhận e → chất oxi hóa
2. Điều kiện phản ứng H2S ra H2SO4
Nhiệt độ thường
3. Cách tiến hành phản ứng H2S tạo ra H2SO4
Sục khí H2S vào dung dịch nước Clo
4. Tính chất hóa học của H2S
4.1. Tính axit yếu
Hiđro sunfua tan trong nước tạo thành dung dịch axit rất yếu (yếu hơn axit cacbonic), có tên là axit sunfuhiđric (H2S).
Axit sunfuhiđric tác dụng với kiềm tạo nên 2 loại muối: muối trung hòa, như Na2S chứa ion S2- và muối axit như NaHS chứa ion HS−.
H2S + NaOH → NaHS + H2O
H2S + 2NaOH → Na2S + 2H2O
4.2. Tính khử mạnh
Là chất khử mạnh vì trong H2S lưu huỳnh có số oxi hoá thấp nhất (-2).
Khi tham gia phản ứng hóa học, tùy thuộc vào bản chất và nồng độ của chất oxi hóa, nhiệt độ,...mà nguyên tố lưu huỳnh có số oxi hóa −2 (S-2) có thể bị oxi hóa thành (S0), (S+4), (S+6).
Tác dụng với oxi có thể tạo S hoặc SO2 tùy lượng ôxi và cách tiến hành phản ứng.
2H2S + 3O2 dư → 2H2O + 2SO2
2H2S + O2 → 2H2O + 2S
Ở nhiệt độ cao, khí H2S cháy trong không khí với ngọn lửa xanh nhạt, H2S bị oxi hóa thành SO2:
Tác dụng với clo có thể tạo S hay H2SO4 tùy điều kiện phản ứng.
H2S + 4Cl2 + 4H2O → 8HCl + H2SO4
H2S + Cl2 → 2HCl + S (khí clo gặp khí H2S)
5. Ứng dụng H2S
- Hidro sunfua dùng để sản xuất lưu huỳnh và axit sunfuric dùng để sản xuất axit sunfuric, các chất trung gian sulfide vô cơ dùng làm nguyên liệu cho những bước tiếp theo của các quy trình sản xuất dược phẩm , thuốc nhuộm, thuốc trừ sâu…
- Sản xuất nước nặng trong một số nhà máy điện hạt nhân cũng là một vai trò của nó .
- Được con người dùng làm chất khử trùng trong nông nghiệp.
- Khí này còn được trong một số loại dầu cắt, chất làm mát và chất bôi trơn,…
6. Tính chất hóa học của Cl2
6.1. Tác dụng với kim loại
Đa số kim loại và có to để khơi màu phản ứng tạo muối clorua (có hoá trị cao nhất)
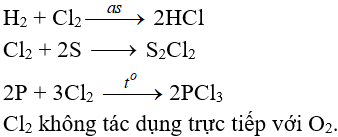
6.2. Tác dụng với phi kim
(cần có nhiệt độ hoặc có ánh sáng)
6.3. Tác dụng với nước và dung dịch kiềm
Cl2 tham gia phản ứng với vai trò vừa là chất oxi hóa, vừa là chất khử.
Tác dụng với nuớc:
Khi hoà tan vào nước, một phần Clo tác dụng (Thuận nghịch)
Cl20 + H2O → HCl + HClO (Axit hipoclorơ)
Axit hipoclorơ có tính oxy hoá mạnh, nó phá hửy các màu vì thế nước clo hay clo ẩm có tính tẩy màu do.
Tác dụng với dung dịch bazơ:
6.4. Tác dụng với muối của các halogen khác
Cl2 + 2NaBr → 2NaCl + Br2
Cl2 + 2FeCl2 → 2FeCl3
3Cl2 + 6FeSO4 → 2Fe2(SO4)3 + 2FeCl3
Cl2 + 2KI → 2KCl + I2
6.5. Tác dụng với chất khử khác
6.6. Phản ứng thế, phản ứng cộng, phản ứng phân huỷ với một số hợp chất hữu cơ
7. Bài tập vận dụng
Câu 1. Cho phản ứng hoá học sau: H2S + 4Cl2 + 4H2O → H2SO4 + 8HCl
Câu nào dưới đây phát biểu đúng:
A. H2S là chất oxi hoá, Cl2 là chất khử
B. H2S là chất khử, Cl2 là chất oxi hoá
C. H2S là chất khử, H2O là chất oxi hoá
D. H2S là chất oxi hoá, H2O là chất khử
Lời giải:
Đáp án: B
Giải thích:
S-2 → S+6 + 6e
→ S-2 nhường e → chất khử.
Cl2 + 2e → 2Cl-.
→ Cl2 nhận e → chất oxi hóa
Câu 2. Các đồ vật bằng bạc để lâu trong không khí thường bị xỉn màu đen. Nguyên nhân gây ra hiện tượng này là do:
A. Bạc tác dụng với O2 trong không khí.
B. Bạc tác dụng với hơi nước.
C. Bạc tác dụng đồng thời với khí O2 và H2S trong không khí.
D. Bạc tác dụng với khí CO2.
Lời giải:
Đáp án: C
Giải thích:
Trong không khí có chứa các chất O2, H2S, hơi nước… Vì vậy Ag tác dụng đồng thời với O2 và H2S tạo muối Ag2S màu đen gây ra hiện tượng xỉn màu.
4Ag + O2+ 2H2S → 2Ag2S + 2H2O
Câu 3. Tiến hành các thí nghiệm sau:
(a). Sục H2S vào dung dịch nước Clo
(b). Sục khí SO2 vào dung dịch KMnO4
(c). Cho H2S vào dung dịch Ba(OH)2
(d). Thêm H2SO4 loãng vào NaClO
(e). Đốt H2S trong oxi không khí.
(f). Sục khí Cl2 vào Ca(OH)2 huyền phù
Nhưng thí nghiệm nào xảy ra phản ứng oxi hoá - khử là
A. (a), (b), (e), (f)
B. (a), (c), (d), (e)
C. (a), (c), (d), (f)
D. (b), (d), (e), (f)
Lời giải:
Đáp án: A
Giải thích:
(a). Sục H2S vào dung dịch nước Clo
(b). Sục khí SO2vào dung dịch KMnO4
(e). Đốt H2S trong oxi không khí.
(f). Sục khí Cl2 vào Ca(OH)2 huyền phù
Câu 4. Dãy chất nào trong các dãy sau đây gồm các chất đều thể hiện tính oxi hóa khi phản ứng với SO2?
A. H2S, O2, nước brom
B. O2, nước brom, dung dịch KMnO4
C. Dung dịch NaOH, O2, dung dịch KMnO4
D. Dung dịch BaCl2, CaO, nước brom
Lời giải:
Đáp án: B
Giải thích:
A. H2S, O2, nước brom.
Sai vì H2S thể hiện tính khử
B. O2, nước brom, dung dịch KMnO4.
Đúng vì SO2 là chất khử ( có số OXH tăng từ +4 lên +6)
C. Dung dịch NaOH, O2, dung dịch KMnO4.
Sai.Vì NaOH không thể tính tính oxh hoặc khử khi tác dụng với SO2
D. Dung dịch BaCl2, H2S, nước brom.
Sai.Vì có BaCl2
Câu 5. Dẫn 8,96 lít (đktc) hỗn hợp khí A gồm H2S và CO2 vào lượng dư dung dịch Pb(NO3)2, thu được 23,9 gam kết tủa. Thành phần phần trăm thể tích của H2S trong A là
A. 25%
B. 50%
C. 60%
D. 75%
Lời giải:
Đáp án: A
Giải thích:
nhh A= 0,4 mol
nPbS= 0,1 mol
Phương trình phản ứng
H2S + Pb(NO3)2→ PbS + 2HNO3
0,1← 0,1
%VH2S = 25%
Câu 6. Khí SO2 (sinh ra từ việc đốt các nhiên liệu hóa thạch, quặng sunfua) là một trong những chất gây ô nhiễm môi trường, do SO2 trong không khí sinh ra:
A. hiện tượng mưa axit
B. hiện tượng nhà kính
C. lỗ thủng tầng ozon
D. nước thải gây ung thư
Lời giải:
Đáp án: A
Câu 7. Phát biểu nào sau đây sai?
A. Ở nhiệt độ thường, H2S là chất khí không màu, có mùi trứng thối, rất độc.
B. Ở nhiệt độ thường, SO2 là chất khí không màu, mùi hắc, tan nhiều trong nước.
C. Ở nhiệt độ thường, SO3 là chất khí không màu, tan vô hạn trong nước.
D. Trong công nghiệp, SO3 là chất khí không màu, tan vô hạn trong nước.
Lời giải:
Đáp án: C
Câu 8. Hiện tượng xảy ra khi dẫn khí SO2 vào dung dịch brom là
A. có kết tủa màu vàng.
B. có khói màu nâu đỏ.
C. có khí mùi hắc thoát ra.
D. dung dịch brom mất màu
Lời giải:
Đáp án: D
Giải thích:
Dung dịch Br2 có màu nâu đỏ, khi sục SO2 vào dung dịch nước Br2 thì dung dịch brom mất màu do xảy ra phản ứng
Phương trình hóa học: SO2 + Br2 + 2H2O → 2HBr + H2SO4
(dung dịch màu nâu đỏ) (dd không màu)
Câu 9. Thí nghiệm nào dưới đây không có phản ứng hóa học xảy ra?
A. Cho Cu vào dung dịch chứa NaNO3 và H2SO4loãng.
B. Sục H2S vào dung dịch CuCl2.
C. Cho dung dịch HCl vào dung dịch Fe(NO3)2.
D. Sục H2S vào dung dịch FeCl2.
Lời giải:
Đáp án: D
Câu 10. Thực hiện các thí nghiệm sau:
(a) Sục khí SO2 vào dung dịch Br2.
(b) Sục khí SO2 vào dung dịch H2S .
(c) Cho Cu vào dung dịch H2SO4 đặc, nóng.
(d) Cho MnO2 vào dung dịch HCl đặc, nóng.
(e) Cho Fe2O3 vào dung dịch H2SO4đặc, nóng.
(f) Cho SiO2 vào dung dịch HF.
Trong các thí nghiệm trên, số thí nghiệm có phản ứng oxi hóa – khử xảy ra là
A. 3
B. 6
C. 4
D. 5
Lời giải:
Đáp án: C
Câu 11. Để điều chế H2S trong phòng thí nghiệm người ta dùng.
A. Cho Hiđrô tác dụng với lưu huỳnh.
B. Cho sắt (II) sunfua tác dụng với axít clohiđríc.
C. Cho sắt sunfua tác dụng với axít nitric
D. Cho sắt tác dụng với H2SO4 đặc nóng
Lời giải:
Đáp án: B
Câu 12. Câu nhận xét về khí H2S nào sau đây là sai ?
A. là khí không màu, mùi trứng thối và rất độc
C. tan trong nước tạo thành dung dịch axit H2S
B. làm quỳ tím ẩm hóa xanh
D. có tính khử mạnh
Lời giải:
Đáp án: C
Câu 13. Thí nghiệm nào dưới đây không có phản ứng hóa học xảy ra?
A. Cho Cu vào dung dịch chứa NaNO3 và H2SO4 loãng.
B. Sục H2S vào dung dịch CuCl2.
C. Cho dung dịch HCl vào dung dịch Fe(NO3)2.
D. Sục H2S vào dung dịch FeCl2.
Lời giải:
Đáp án: D
Giải thích:
Phương trình phản ứng
A. 2NaNO3+ 3Cu + 4H2SO4 → 2NO + 3CuSO4 + Na2SO4 + 4H2O
B. H2S + CuCl2 → CuS đen + H2S
C. 12HCl + 9Fe(NO3)2→ 5Fe(NO3)3 + 4FeCl3 + 3NO + 6H2O
Câu 14. Sục khí H2S vào dung dịch CuCl2. Hiện tượng quan sát thấy là
A. Có xuất hiện kết tủa xanh
B Không thấy hiện tượng gì
C. Dung dịch từ màu xanh chuyển sang không màu
D. Xuất hiện kết tủa đen
Lời giải:
Đáp án: D
Giải thích:
Phương trình phản ứng
H2S + CuCl2 → CuS đen + H2S
Sục khí H2S vào dung dịch CuCl2. Hiện tượng quan sát thấy là Xuất hiện kết tủa đen
Câu 15. Khẳng định nào sau đây là đúng khi nói về tính chất hóa học của hiđro sunfua.
A. Tính axit mạnh và tính khử yếu.
B. Tính bazơ yếu và tính oxi hóa mạnh.
C. Tính bazơ yếu và tính oxi hóa yếu.
D. Tính axit yếu và tính khử mạnh.
Lời giải:
Đáp án: D
Câu 16. Tiến hành các thí nghiệm sau
(1).Sục khí H2S vào dung dịch FeSO4.
(2). Sục khí H2S vào dung dịch CuSO4.
(3). Sục khí CO2 dư vào dung dịch Na2SiO3.
(4). Sục khí CO2 dư vào dung dịch Ca(OH)2.
(5).Nhỏ từ từ dung dịch NH3 đến dư vào dung dịch Al2(SO4)3.
(6). Nhỏ từ từ dung dịch Ba(OH)2 đến dư vào dung dịch Al2(SO4)3.
Sau khi các phản ứng xảy ra hoàn toàn, số thí nghiệm thu được kết tủa là
A. 3.
B. 6.
C. 5.
D. 4.
Lời giải:
Đáp án: D
Giải thích:
Tiến hành thí nghiệm sau:
1) H2S + FeSO4→ không phản ứng.
2) H2S + CuSO4→ CuS↓ + H2SO4
3) 2CO2+ 2H2O + Na2SiO3→ H2SiO3↓ + 2NaHCO3
4) CO2 + Ca(OH)2 → CaCO3↓ + H2O
CO2 dư + H2O + CaCO3 → Ca(HCO3)2
5) 6NH3 + 6H2O + Al2(SO4)3 → Al(OH)3↓ + 3(NH4)2SO4
6) 3Ba(OH)2 + Al2(SO4)3 → 3BaSO4 ↓ + 2Al(OH)3↓
Ba(OH)2 dư + 2Al(OH)3→ Ba[Al(OH)4]2.
=> Các thí nghiêm (2); (3); (5) và (6) thu được kết tủa
Xem thêm các phương trình phản ứng hóa học khác:
NaHCO3 + H2SO4 → Na2SO4 + CO2 + H2O
Na2CO3 + H2SO4 → Na2SO4 + CO2 + H2O
Xem thêm các chương trình khác:
- Các dạng bài tập Tiếng Anh thông dụng nhất
- 3000 câu hỏi ôn tập môn Tiếng Anh có đáp án
- Toàn bộ kiến thức về cụm động từ | Định nghĩa và cách dùng
- 500 đoạn văn Tiếng Anh thông dụng nhất và cách làm
- 1000 câu hỏi ôn tập môn Công nghệ có đáp án
- 1000 câu hỏi ôn tập Giáo dục công dân
- 15000 câu hỏi ôn tập môn Toán có đáp án
- Wiki Toán | Khái niệm, định lí, tính chất, dạng bài, công thức
- Tuyển tập đề thi + chuyên đề ôn thi Toán Kangaroo các cấp độ (có đáp án 2024)
- 3000 câu hỏi ôn tập môn Vật lí có đáp án
- Tổng hợp Dạng bài - Công thức môn Vật lí
- 2000 câu hỏi ôn tập môn Tin học có đáp án
- 3000 câu hỏi ôn tập môn Lịch sử có đáp án
- 3000 câu hỏi ôn tập môn Địa lí có đáp án
- 2000 câu hỏi ôn tập môn Sinh học có đáp án
- Tổng hợp Dạng bài - Công thức môn Sinh học
- Tổng hợp về các tác giả văn học
- 3000 câu hỏi ôn tập môn Ngữ văn có đáp án
- Tổng hợp kiến thức Ngữ Văn
- Tuyển tập truyện dân gian, truyền thuyết, cổ tích,... Việt Nam
- Tổng hợp các đề đọc - hiểu có đáp án chi tiết
- Trò chơi Powerpoint | Game Powerpoint
- Tổng hợp bài thu hoạch BDTX Giáo viên mầm non (2025) theo Thông tư 12
- Tổng hợp bài thu hoạch BDTX Giáo viên tiểu học (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THCS (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THPT (2025)