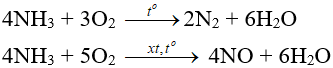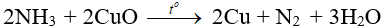AgNO3 + H2O + NH3 + HCOOH → (NH4)2CO3 + Ag + NH4NO3 l AgNO3 ra Ag
AgNO3 + H2O + NH3 + HCOOH → (NH4)2CO3 + Ag + NH4NO3 là phản ứng tráng bạc. Bài viết này cung cấp đầy đủ thông tin về phương trình hóa học đã được cân bằng, điều kiện các chất tham gia phản ứng, hiện tượng (nếu có), ... Mời các bạn đón xem:
Phản ứng AgNO3 + H2O + NH3 + HCOOH → (NH4)2CO3 + Ag + NH4NO3
1. Phương trình Axit fomic tác dụng với AgNO3
2AgNO3 + H2O + 4NH3 + HCOOH → (NH4)2CO3 + 2Ag↓ + 2NH4NO3
2. Điều kiện phản ứng HCOOH tác dụng với dung dịch AgNO3/NH3
Điều kiện: Không có
3. Cách tiến hành phản ứng cho HCOOH tác dụng với dung dịch AgNO3/NH3
Cho axit formic HCOOH tác dụng với AgNO3 trong dung dịch NH3.
4. Hiện tượng hóa học
Axit fomic HCOOH tác dụng với AgNO3 trong dung dịch NH3 tạo ra kết tủa trắng bạc, hay còn gọi là phản ứng tráng gương.
5. Tính chất hóa học của axit fomic
5.1. Axit fomic mang tính chất của axit yếu
5.1.1. Axit fomic làm quỳ tím chuyển thành màu đỏ nhạt.
5.1.2. Axit fomic tác dụng với kim loại mạnh.
2K + 2HCOOH → 2HCOOK + H2
5.1.3. Tác dụng với oxit bazơ.
ZnO + 2HCOOH → (HCOO)2Zn + H2O
5.1.4. Axit fomic tác dụng với bazơ.
KOH + HCOOH → HCOOK + H2O
5.1.5. Axit fomic tác dụng với muối của axit yếu hơn.
NaHCO3 + HCOOH → HCOONa + CO2+ H2O
5.2. Phản ứng đặc trưng của Axit fomic
5.2.1. Phản ứng este hóa.
HCOOH + CH3OH → HCOOCH3 + H2O.
(Đây là phản ứng thuận nghịch được xúc tác nhờ axit sunfuric đặc và nhiệt độ).
5.2.2. Phản ứng tráng gương.
2AgNO3 + H2O + 4NH3 + HCOOH → (NH4)2CO3 + 2Ag↓ + 2NH4NO3
6. Mở rộng kiến thức về AgNO3
6.1. Tính chất vật lí & nhận biết
- Tính chất vật lí: Là chất rắn, có màu trắng, tan tốt trong nước, có nhiệt độ nóng chảy là 212oC.
- Nhận biết: Sử dụng muối NaCl, thu được kết tủa trắng
AgNO3 + NaCl →AgCl↓+ NaNO3
6.2. Tính chất hóa học
- Mang tính chất hóa học của muối
Tác dụng với muối
AgNO3 + NaCl →AgCl↓+ NaNO3
2AgNO3 + BaCl2 →2AgCl↓+ Ba(NO3)2
Tác dụng với kim loại:
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag
Tác dụng với axit:
AgNO3 + HI → AgI ↓ + HNO3
Oxi hóa được muối sắt (II)
Fe(NO3)2 + AgNO3 → Fe(NO3)3 + Ag
6.3. Điều chế
- Bạc nitrat điều chế bằng cách hòa tan kim loại bạc trong dung dịch axit nitric.
3Ag + 4 HNO3(loãng) → 3AgNO3 + 2H2O + NO
3Ag + 6 HNO3(đặc, nóng) → 3AgNO3 + 3 H2O + 3NO2
6.4. Ứng dụng
- Hóa phân tích:
Bạc Nitrat được sử dụng để kết tủa các ion clorua và cơ sở hoạt động của bạc nitrat được sử dụng để hiệu chuẩn dung dịch natri clorua.
- Trong công nghiệp:
AgNO3 được sử dụng để sản xuất muối bạc khác.
AgNO3 được sử dụng để tạo ra chất kết dính dẫn điện, máy lọc khí mới, sàng phân tử A8x , quần áo cân bằng áp suất mạ bạc và găng tay để làm việc trực tiếp.
AgNO3 được sử dụng để làm vật liệu nhạy sáng cho phim, phim x-quang và phim ảnh.
AgNO3 sử dụng để mạ bạc các linh kiện điện tử và thủ công mỹ nghệ khác và cũng được sử dụng rộng rãi làm vật liệu mạ bạc cho gương và phích nước.
AgNO3 được sử dụng để sản xuất pin bạc-kẽm.
- Ứng dụng trong y học:
AgNO3 được sử dụng trong y học để ăn mòn mô hạt tăng sinh và dung dịch loãng được sử dụng làm thuốc diệt nấm cho nhiễm trùng mắt.
7. Tính chất hoá học của NH3
7.1. Tính bazơ yếu
- Tác dụng với nước:
NH3 + H2O ⇋ NH4+ + OH-
⇒ Dung dịch NH3 là một dung dịch bazơ yếu.
- Tác dụng với dung dịch muối (muối của những kim loại có hidroxit không tan):
AlCl3 + 3NH3 + 3H2O → Al(OH)3↓ + 3NH4Cl
Al3+ + 3NH3 + 3H2O → Al(OH)3↓ + 3NH4+
- Tác dụng với axit → muối amoni:
NH3 + HCl → NH4Cl (amoni clorua)
2NH3 + H2SO4 → (NH4)2SO4 (amoni sunfat)
7.2. Khả năng tạo phức
Dung dịch amoniac có khả năng hòa tan hiđroxit hay muối ít tan của một số kim loại, tạo thành các dung dịch phức chất.
Ví dụ:
* Với Cu(OH)2:
Cu(OH)2 + 4NH3 → [Cu(NH3)4](OH)2 (màu xanh thẫm)
* Với AgCl:
AgCl + 2NH3 → [Ag(NH3)2]Cl
Sự tạo thành các ion phức là do sự kết hợp các phân tử NH3 bằng các electron chưa sử dụng của nguyên tử nitơ với ion kim loại.
7.3. Tính khử
Amoniac có tính khử: phản ứng được với oxi, clo và khử một số oxit kim loại (Nitơ có số oxi hóa từ -3 đến 0, +2).
- Tác dụng với oxi:
- Tác dụng với clo:
2NH3 + 3Cl2 → N2 + 6HCl
NH3 kết hợp ngay với HCl vừa sinh ra tạo “khói trắng” NH4Cl
- Tác dụng với CuO:
8. Bài tập vận dụng liên quan
Câu 1. Cho một lượng axit HCOOH tác dụng hoàn toàn với lượng dư dung dịch AgNO3/NH3 thu được 10,8 gam Ag. Tính lượng axit đã phản ứng
A. 2,3 gam
B. 4,6 gam
C. 1,15 gam
D. 9,2 gam
Lời giải:
Câu 2. Chất nào dưới đây tham gia phản ứng tráng gương (tráng bạc):
A. HCOOC2H5
B. CH3-O-CH3
C. CH2=CH2
D. C2H5OH
Lời giải:
HCOOC2H5 có khả năng tham gia phản ứng tráng gương do có cấu tạo HCOOR dạng RO-CHO ⇒ nhóm –CHO có khả năng tráng gương:
RO-CHO + 2AgNO3 + 3NH3 + H2O → ROCOONH4 + 2Ag↓ + 2NH4NO3.
Theo đó, ta chọn đáp án C.
Câu 3. Công thức tổng quát của axit cacboxylic no, đơn chức, mạch hở là
A. CnH2nO2.
B. CnH2n+2O2.
C. CnH2n+1O2.
D. CnH2n-1O2.
Lời giải:
Công thức tổng quát của axit cacboxylic no, đơn chức, mạch hở là CnH2nO2.
Câu 4. Dùng hóa chất nào dưới đây để phân biệt axit fomic và axit axetat?
A. CO2
B. Quỳ tím
C. NaOH
D. Dung dịch AgNO3/NH3
Lời giải:
Vì HCOOH còn nhóm –CHO và axit axetic không còn nhóm –CHO nên để phân biệt axit fomic (HCOOH) và axit axetic (CH3COOH) có thể dùng thuốc thử là dung dịch AgNO3/NH3, phản ứng khi cho HCOOH tác dụng dung dịch AgNO3/NH3, xuất hiện kết tủa Ag:
Phương trình phản ứng
HCOOH + 2AgNO3+ 4NH3 + H2O ⇔ (NH4)2CO3 +2Ag↓ + 2NH4NO3
Không xuất hiện, hiện tượng gì là CH3COOH
Câu 5. Chất nào sau đây có thể làm khô khí NH3 có lẫn hơi nước?
A. P2O5.
B. H2SO4 đặc.
C. CuO bột.
D. NaOH rắn.
Lời giải:
Để có thể trả lời câu hỏi này bạn đọc cần ghi nhớ nguyên tắc chung:
Chất làm khô là chất có khả năng hút ẩm mạnh.
Chất làm khô không tác dụng, không hòa tan với khí (cả khi có nước)
Trong quá trình làm khô khí thì không giải phóng khi khác.
Câu 6. Tính bazơ của NH3 do
A. trên N còn cặp e tự do.
B. phân tử có 3 liên kết cộng hóa trị phân cực.
C. NH3 tan được nhiều trong nước.
D. NH3 tác dụng với nước tạo NH4OH.
Lời giải:
Tính bazơ của NH3 là do trên nguyên tử N còn cặp e tự do không tham gia liên kết.
Theo thuyết bronsted, bazo là chất nhận proton
Theo thuyết areniut, bazo là chất tan trong nước phân li ra ion OH-
H2O + NH3 ⇌ OH– + NH4+
Câu 7. Để tách riêng NH3 ra khỏi hỗn hợp gồm N2, H2, NH3 trong công nghiệp người ta đã
A. Cho hỗn hợp qua nước vôi trong dư.
B. Cho hỗn hợp qua bột CuO nung nóng.
C. nén và làm lạnh hỗn hợp để hòa lỏng NH3.
D. Cho hỗn hợp qua dung dịch H2SO4 đặc.
Lời giải:
Để tách riêng NH3 ra khỏi hỗn hợp gồm N2, H2, NH3 trong công nghiệp, người ta đã nén và làm lạnh hỗn hợp để hóa lỏng NH3
Câu 8. Chất nào sau đây có thể làm khô khí NH3 có lẫn hơi nước?
A. P2O5.
B. H2SO4 đặc.
C. CuO bột.
D. NaOH rắn.
Lời giải:
Nguyên tắc chung:
Chất làm khô là chất có khả năng hút ẩm mạnh.
Chất làm khô không tác dụng, không hòa tan với khí (cả khi có nước)
Trong quá trình làm khô khí thì không giải phóng khi khác.
Chất có thể làm khô NH3 là NaOH rắn.
Câu 9. Trong các phản ứng sau, phản ứng nào NH3 đóng vai trò là chất oxi hóa?
A. 2NH3 + H2O2 + MnSO4 → MnO2 + (NH4)2SO4
B. 2NH3 + 3Cl2 → N2 + 6HCl
C. 4NH3 + 5O2 → 4NO + 6H2O
D. 2NH3 + 2Na → 2NaNH2 + H2
Lời giải:
Câu 10. Cho 19,8 gam một anđehit đơn chức A phản ứng hoàn toàn với dung dịch AgNO3/NH3 (dư). Lượng Ag sinh ra phản ứng hết với dung dịch HNO3 loãng được 6,72 lít NO ở đktc. A có công thức phân tử là
A. C2H4O.
B. C3H6O.
C. C3H4O.
D. C4H8O.
Lời giải:
Đặt công thức hóa học của A là RCHO
RCHO + AgNO3/NH3 → xAg
3Ag + 4HNO3 → 3AgNO3 + NO + 2H2O
0,9 ← 0,3
→ nAg = 0,9 mol
Nếu A là HCHO thì nA = = 0,225 mol → mA = 0,225.30 =6,75 < 19,8
→ A không phải HCHO
RCHO + AgNO3/NH3 → 2Ag
0,45 ← 0,9
→ MA = = 44 → MR = 44 – 29 =15 (CH3)
→ A là CH3CHO
Câu 11. Axit axetic có thể làm quỳ tím chuyển sang màu hồng, tác dụng với bazơ, oxit bazơ, kim loại trước H và với muối, bởi vì trong phân tử có chứa
A. nguyên tử O.
B. 3 nguyên tử C, H, O.
C. nhóm –CH3
D. có nhóm –COOH.
Lời giải:
Axit axetic có thể làm quỳ tím chuyển sang màu hồng, tác dụng với bazơ, oxit bazơ, kim loại trước H và với muối, bởi vì trong phân tử có chứa nhóm –COOH.
Câu 12. Dãy chất tác dụng với axit axetic là
A. ZnO; Cu(OH)2; Cu; CuSO4; C2H5OH.
B. CuO; Ba(OH)2; Zn ; Na2CO3; C2H5OH.
C. Ag; Cu(OH)2; ZnO; H2SO4; C2H5OH.
D. H2SO4; Cu(OH)2; C2H5OH; C6H6; CaCO3.
Lời giải:
Dãy chất tác dụng với axit axetic là
CuO; Ba(OH)2; Zn ; Na2CO3; C2H5OH
Phương trình hóa học xảy ra:
2CH3COOH + CuO ⟶ (CH3COO)2Cu + H2O
2CH3COOH + Ba(OH)2 → 2H2O + Ba(CH3COO)2
Zn + 2CH3COOH → Zn(CH3COO)2 + H2
2CH3COOH + Na2CO3 → 2CH3COONa + H2O + CO2
CH3COOH + C2H5OH CH3COOC2H5 + H2O
Câu 13. Trong công nghiệp một lượng lớn axit axetic được điều chế bằng cách
A. nhiệt phân metan sau đó làm lạnh nhanh.
B. lên men dung dịch rượu etylic.
C. oxi hóa etan có xúc tác và nhiệt độ thích hợp.
D. oxi hóa butan có xúc tác và nhiệt độ thích hợp.
Lời giải:
Trong công nghiệp, một lượng lớn axit axetic được điều chế bằng cách: oxi hóa butan có xúc tác nhiệt và nhiệt độ thích hợp.
Câu 14. Phản ứng giữa axit axetic với dung dịch bazơ thuộc loại
A. phản ứng oxi hóa - khử.
B. phản ứng hóa hợp.
C. phản ứng phân hủy.
D. phản ứng trung hòa.
Lời giải:
Phản ứng giữa axit axetic với dung dịch bazơ thuộc loại phản ứng trung hòa.
Câu 15. Để phân biệt dung dịch axit axetic và rượu etylic ta dùng kim loại nào sau đây?
A. Na.
B. Zn.
C. K.
D. Cu.
Lời giải:
Để phân biệt dung dịch axit axetic và rượu etylic ta dùng kim loại là Zn.
Mẩu kẽm phản ứng, có khí thoát ra → CH3COOH
Phương trình hóa học
Zn + 2CH3COOH → (CH3COO)2Zn + H2
Không có hiện tượng gì xuất hiện → C2H5OH
Câu 16. Cho các phát biểu sau:
(a) Este tạo bởi axit fomic cho phản ứng tráng bạc.
(b) Đun nóng chất béo với dung dịch loãng, thu được xà phòng và glixerol.
(c) Trong một phân tử tripeptit thì số nguyên tử nitơ là 3.
(d) Chỉ có các monome chứa các liên kết bội mới tham gia được phản ứng trùng hợp.
(e) Saccarozơ làm mất màu dung dịch thuốc tím ( ).
Số phát biểu sai là
A. 4.
B. 3.
C. 5.
D. 2.
Lời giải:
(b) Sai, Đun nóng chất béo với dung dịch H2SO4 loãng, thu được axit béo và glixerol.
(c) Sai, Trong một phân tử tripeptit thì số nguyên tử nitơ là 3 khi các α-aminoaxit tạo thành chỉ có 1 nhóm –NH4
(d) Sai, Các monome chứa các liên kết bội hoặc vòng kém bền tham gia phản ứng trùng hợp tạo polime.
(e) Sai, Saccarozơ không làm mất màu dung dịch thuốc tím (KMnO4).
Câu 17. Cho các chất sau: ZnO, Na2SO4, KOH, Na2CO3, Cu, Fe. Số chất có thể tác dụng với dung dịch axit axetic là
A. 1.
B. 2.
C. 3.
D. 4.
Lời giải:
Các chất có thể tác dụng với axit axetic là: ZnO, KOH, Na2CO3, Fe.
2CH3COOH + ZnO → (CH3COO)2Zn + 2H2O
CH3COOH + KOH → CH3COOK + H2O
2CH3COOH + Na2CO3 → 2CH3COONa + CO2 + H2O
2CH3COOH + Fe → (CH3COO)2Fe + H2
Câu 18. Đun nóng axit axetic với rượu etylic có axit sunfuric làm xúc tác thì người ta thu được một chất lỏng không màu, mùi thơm, không tan trong nước và nổi trên mặt nước. Sản phẩm đó là
A. metyl clorua.
B. natri axetat.
C. etyl axetat.
D. etilen
Lời giải:
Phương trình hóa học
CH3COOH + C2H5-OH CH3COOC2H5 + H2O
=> sản phẩm thu được là: etyl axetat
Câu 19. Có 3 lọ mất nhãn chứa 3 chất lỏng: rượu etylic, axit axetic, etyl axetat bằng cách nào sau đây để có thể nhận biết 3 dung dịch trên?
A. Na2CO3 khan.
B. Na, nước.
C. dung dịch Na2CO3.
D. Cu, nước.
Lời giải:
Dùng dung dịch Na2CO3 để nhận biết.
Cho dung dịch Na2CO3 vào 3 dung dịch, lọ đựng dung dịch axit axetic sủi bọt khí, lọ tạo dung dịch phân lớp là etyl axetat, lọ không hiện tượng là rượu etylic.
2CH3COOH + Na2CO3 → 2CH3COONa + H2O + CO2
Xem thêm các phương trình hóa học khác:
Xem thêm các chương trình khác:
- Các dạng bài tập Tiếng Anh thông dụng nhất
- 3000 câu hỏi ôn tập môn Tiếng Anh có đáp án
- Toàn bộ kiến thức về cụm động từ | Định nghĩa và cách dùng
- 500 đoạn văn Tiếng Anh thông dụng nhất và cách làm
- 1000 câu hỏi ôn tập môn Công nghệ có đáp án
- 1000 câu hỏi ôn tập Giáo dục công dân
- 15000 câu hỏi ôn tập môn Toán có đáp án
- Wiki Toán | Khái niệm, định lí, tính chất, dạng bài, công thức
- Tuyển tập đề thi + chuyên đề ôn thi Toán Kangaroo các cấp độ (có đáp án 2024)
- 3000 câu hỏi ôn tập môn Vật lí có đáp án
- Tổng hợp Dạng bài - Công thức môn Vật lí
- 2000 câu hỏi ôn tập môn Tin học có đáp án
- 3000 câu hỏi ôn tập môn Lịch sử có đáp án
- 3000 câu hỏi ôn tập môn Địa lí có đáp án
- 2000 câu hỏi ôn tập môn Sinh học có đáp án
- Tổng hợp Dạng bài - Công thức môn Sinh học
- Tổng hợp về các tác giả văn học
- 3000 câu hỏi ôn tập môn Ngữ văn có đáp án
- Tổng hợp kiến thức Ngữ Văn
- Trò chơi Powerpoint | Game Powerpoint
- Tổng hợp bài thu hoạch BDTX Giáo viên mầm non (2024) theo Thông tư 12
- Tổng hợp bài thu hoạch BDTX Giáo viên tiểu học (2024)
- Tổng hợp bài thu hoạch BDTX Giáo viên THCS (2024)
- Tổng hợp bài thu hoạch BDTX Giáo viên THPT (2024)