Li + I2 → LiI l Li ra LiI
Li + I2 → LiI là phản ứng oxi hóa khử. Bài viết này cung cấp đầy đủ thông tin về phương trình hóa học đã được cân bằng, điều kiện các chất tham gia phản ứng, hiện tượng (nếu có), ... Mời các bạn đón xem:
Phản ứng Li + I2 → LiI
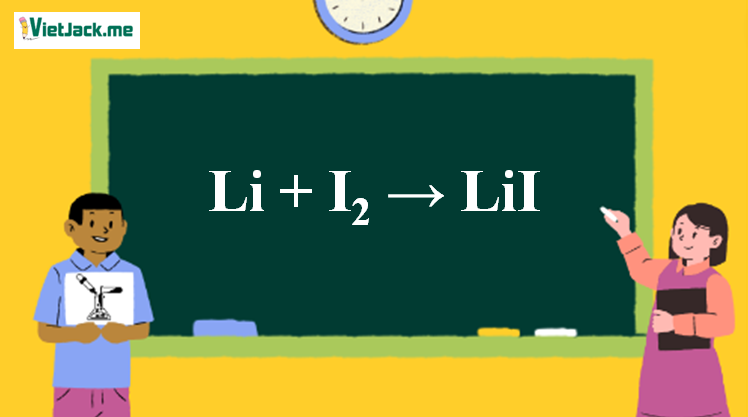
1. Phản ứng hóa học
2Li + I2 → 2LiI
2. Điều kiện phản ứng
Nhiệt độ >1000C
3. Cách thực hiện phản ứng
Cho Li tác dụng với iot thu được muối Litiiotua.
4. Hiện tượng nhận biết phản ứng
Liti nóng chảy cháy sáng trong iot tạo thành muối màu đen.
5. Bản chất của các chất tham gia phản ứng
5.1. Bản chất của Li (Liti)
- Trong phản ứng trên Li là chất khử.
- Li có tính khử rất mạnh, tham gia phản ứng với halogen (I2; Cl2; Br2,…) phản ứng tỏa nhiều nhiệt tạo thành muối.
5.2. Bản chất của I2 (Clo)
Trong phản ứng trên I2 là chất oxi hóa.
6. Tính chất hóa học của Li
Liti là kim loại kiềm có tính khử rất mạnh.
Li → Li+ + 1e
6.1. Tác dụng với phi kim
6.2. Tác dụng với axit
Liti dễ dàng khử ion H+ (hay H3O+) trong dung dịch axit loãng (HCl, H2SO4 loãng...) thành hidro tự do.
2Li + 2HCl → 2LiCl + H2.
2Li + H2SO4 → Li2SO4 + H2.
6.3. Tác dụng với nước
Li tác dụng chậm với nước tạo thành dung dịch kiềm và giải phóng khí hidro.
2Li + 2H2O → 2LiOH + H2.
6.4. Tác dụng với hidro
Liti tác dụng với hidro ở áp suất khá lớn và nhiệt độ khoảng 350 – 400oC tạo thành Liti hidrua.
2Li (lỏng) + H2 (khí) → 2LiH (rắn)
7. Ứng dụng của Li
Lithi và các hợp chất của nó có nhiều ứng dụng công nghiệp như thủy tinh cách nhiệt và gốm sứ, dầu nhờn lithi, phụ gia trong sản xuất sắt, thép và nhôm, pin lithi và pin ion lithi.
8. Tính chất hoá học của I2
8.1. Tác dụng với kim loại
Iot oxi hóa được nhiều kim loại nhưng chỉ xảy ra khi đun nóng hoặc có xúc tác.
8.2. Tác dụng với hidro
H2 + I2 → 2HI phản ứng xảy ra thuận nghịch.
- Hidro Iotua dễ tan trong nước tạo thành dd axit Iothidric, đó là 1 axit rất mạnh, mạnh hơn cả axit clohidric, bromhidric.
- Iot hầu như không tác dụng với H2O.
8.3. Iot có tính oxi hóa kém clo và brom
Cl2 + 2NaI → 2NaCl + I2
Br2 + 2NaI → 2NaBr + I2
8.4. Tính khử của axit HI
HI có tính khử mạnh có thể khử được axit H2SO4 đặc.
8HI + H2SO4 → 4I2 + H2S + 4H2O
2HI + 2FeCl3 → FeCl2 + I2 + 2HCl
8.5. Tính chất đặc trưng của Iot
Iot có tính chất đặc trưng là tác dụng với hồ tinh bột tạo thành hợp chất có màu xanh.
9. Câu hỏi vận dụng
Câu 1. Cho 0,7 g kim kiềm M tác dụng vừa đủ với 12,7 g iot đun nóng. Kim loại M là
A. Li B. Na C. K D. Rb
Lời giải:
Đáp án: A
Phương trình phản ứng: 2M + I2 → 2MI
nM = 2.nI2 = 2. = 2.0,05 = 0,1 mol ⇒ M = 7 ⇒ M là Li
Câu 2. Muốn bảo quản kim loại kiềm, người ta ngâm kín chúng trong chất nào?
A. Nước tinh khiết
B. Dung dịch H2SO4
C. Dung dịch KOH
D. Dầu hỏa
Lời giải:
Đáp án: D
Vì Kim loại kiềm không phản ứng với dầu hỏa
Câu 3. Kim loại kiềm là kim loại
A. Có lớp vỏ ngoài cùng chứa 1 e
B. Đứng đầu mỗi chu kì (trừ chu kì 1)
C. Có tính khử rất mạnh
D. Tất cả đều đúng
Lời giải:
Đáp án: D
Xem thêm các phương trình phản ứng hóa học khác:
Xem thêm các chương trình khác:
- Các dạng bài tập Tiếng Anh thông dụng nhất
- 3000 câu hỏi ôn tập môn Tiếng Anh có đáp án
- Toàn bộ kiến thức về cụm động từ | Định nghĩa và cách dùng
- 500 đoạn văn Tiếng Anh thông dụng nhất và cách làm
- 1000 câu hỏi ôn tập môn Công nghệ có đáp án
- 1000 câu hỏi ôn tập Giáo dục công dân
- 15000 câu hỏi ôn tập môn Toán có đáp án
- Wiki Toán | Khái niệm, định lí, tính chất, dạng bài, công thức
- Tuyển tập đề thi + chuyên đề ôn thi Toán Kangaroo các cấp độ (có đáp án 2024)
- 3000 câu hỏi ôn tập môn Vật lí có đáp án
- Tổng hợp Dạng bài - Công thức môn Vật lí
- 2000 câu hỏi ôn tập môn Tin học có đáp án
- 3000 câu hỏi ôn tập môn Lịch sử có đáp án
- 3000 câu hỏi ôn tập môn Địa lí có đáp án
- 2000 câu hỏi ôn tập môn Sinh học có đáp án
- Tổng hợp Dạng bài - Công thức môn Sinh học
- Tổng hợp về các tác giả văn học
- 3000 câu hỏi ôn tập môn Ngữ văn có đáp án
- Tổng hợp kiến thức Ngữ Văn
- Trò chơi Powerpoint | Game Powerpoint
- Tổng hợp bài thu hoạch BDTX Giáo viên mầm non (2024) theo Thông tư 12
- Tổng hợp bài thu hoạch BDTX Giáo viên tiểu học (2024)
- Tổng hợp bài thu hoạch BDTX Giáo viên THCS (2024)
- Tổng hợp bài thu hoạch BDTX Giáo viên THPT (2024)