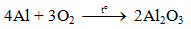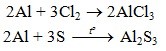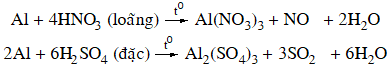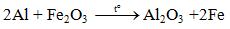Al + FeCl3 → AlCl3 + Fe | Al ra AlCl3
Al + FeCl3 → AlCl3 + Fe là phản ứng thế. Bài viết này cung cấp đầy đủ thông tin về phương trình hóa học đã được cân bằng, điều kiện các chất tham gia phản ứng, hiện tượng (nếu có), ... Mời các bạn đón xem:
Phản ứng Al + FeCl3 → AlCl3 + Fe
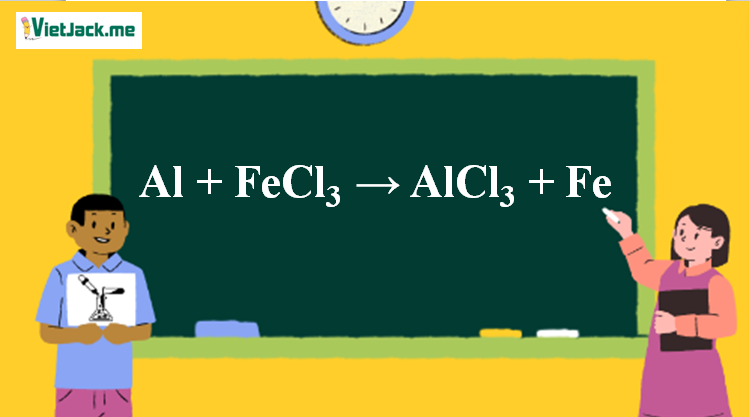
1. Phương trình phản ứng FeCl3 ra Fe
Al + FeCl3 → AlCl3 + Fe
2. Điều kiện phản ứng xảy ra giữa Al + FeCl3
Nhiệt độ thường
3. Bản chất của các chất tham gia phản ứng
3.1. Bản chất của Al (Nhôm)
Al phản ứng với dụng dịch muối của kim loại yếu hơn (trong dãy điện hoá) tạo thành muối mới và giải phóng kim loại yếu ra khỏi muối.
3.2. Bản chất của FeCl3 (Sắt (III) clorua)
FeCl3 có tính oxi hoá tác dụng được với Al.
4. Tính chất hoá học của Al
Nhôm là kim loại có tính khử mạnh: Al → Al3+ + 3e
4.1. Tác dụng với phi kim
a) Tác dụng với oxi
Al bền trong không khí ở nhiệt độ thường do có lớp màng oxit Al2O3 rất mỏng bảo vệ.
b) Tác dụng với phi kim khác
4.2. Tác dụng với axit
+ Axit không có tính oxi hóa: dung dịch axit HCl, H2SO4 loãng
2Al + 6HCl → 2AlCl3 + 3H2↑
+ Axit có tính oxi hóa mạnh: dung dịch HNO3 loãng, HNO3 đặc, nóng và H2SO4 đặc, nóng.
Nhôm bị thụ động hoá trong dung dịch HNO3 đặc, nguội hoặc H2SO4 đặc nguội.
4.3. Tác dụng với oxit kim loại (Phản ứng nhiệt nhôm)
Lưu ý: Nhôm chỉ khử oxit của các kim loại đứng sau nhôm
4.4. Tác dụng với nước
Phá bỏ lớp oxit trên bề mặt Al (hoặc tạo thành hỗn hống Al-Hg thì Al sẽ phản ứng với nước ở nhiệt độ thường)
2Al + 6H2O → 2Al(OH)3↓ + 3H2↑
4.5. Tác dụng với dung dịch kiềm
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑
4.6. Tác dụng với dung dịch muối
Al đẩy được kim loại đứng sau ra khỏi dung dịch muối của chúng:
2Al + 3CuSO4 → Al2(SO4)3 + 3Cu
4.7. Ứng dụng của Al
- Tính năng tuyệt vời nhất của Al là khả năng chống mài mòn tuyệt vời và độ bền cao, được sử dụng trong nhiều lĩnh vực như thực phẩm, dược phẩm, công nghiệp, gia dụng ...
- Nhôm là một kim loại, nhưng hợp chất của nó, alumin, có những đặc tính khiến nó trở thành vật liệu sinh học. Do đặc tính mịn của oxit nhôm nên nó được sản xuất rất an toàn và bảo vệ các bề mặt tiếp xúc của các bộ phận giả trên cơ thể (hông, vai, chân, tay, v.v.) mà không gây hại cho sức khỏe. Ngoài ra, nhôm oxit còn được các hãng mỹ phẩm sử dụng để làm kem che khuyết điểm, son môi, phấn má hồng… nhờ đặc tính tạo độ bóng và mịn của nó.
- Máy cắt rất dễ kiếm và các bộ phận trong nhà máy sản xuất được làm bằng Al. Với đặc tính sáng và không rỉ sét, Al dần trở thành vật liệu không thể thiếu đối với mọi nhà máy. Một số mặt hàng được làm bằng Al, chẳng hạn như: Khung xe máy, khung xe hơi, thùng xe tải, các chi tiết tản nhiệt...
Đặc biệt, Al được sử dụng trong sản xuất trong ngành hàng không vũ trụ. Thân máy bay và cánh được làm bằng nhôm. Các ứng dụng dựa vào trọng lượng riêng nhẹ và bền của nhôm là rất cần thiết để tiết kiệm tối đa trọng lượng trong không khí.
5. Một số nội dung liên quan đến muối Sắt (III) clorua
5.1. Tính chất hóa học muối sắt (III) clorua
Muối sắt (III) clorua có tính oxi hoá. Tác dụng với sắt với phương trình phản ứng sau:
2FeCl3 + Fe → 3FeCl2
Tác dụng với kim loại Cu để tạo ra muối sắt II clorua và đồng clorua:
Cu + 2FeCl3 → CuCl2 + 2FeCl2
Khi sục khí H2S vào sẽ có hiện tượng vẫn đục.
2FeCl3 + H2S → 2FeCl2+ 2HCl + S
Khi được cho vào dung dịch KI và benzen sẽ xảy ra hiện tượng dung dịch có màu tím.
2FeCl3 + 2KI → 2FeCl2 + 2KCl + I2
5.2. Điều chế Muối sắt (III) clorua
- Hóa chất này được điều chế trực tiếp từ phản ứng của Fe với chất oxi hóa mạnh như Cl2, HNO3, H2SO4 đặc nóng như sau:
2Fe + 3Cl2 → 2FeCl3
2Fe + 6H2O + 6NO2Cl ⟶ 3H2+ 6HNO3 + 2FeCl3
Fe + 4HCl + KNO3 ⟶ 2H2O + KCl + NO + FeCl3
- Điều chế từ hợp chất Fe(III) với axit HCl:
Fe2O3 + 6HCl → 2FeCl3 + 3H2O
FeS2 + 3HCl + 5HNO3 ⟶ 2H2O + 2H2SO4 + 5NO + FeCl3.
6. Bài tập vận dụng liên quan
Câu 1. Cho một lá nhôm vào ống nghiệm chứa dung dịch Hg(NO3)2, thấy có một lớp thủy ngân bám trên bề mặt nhôm. Hiện tượng tiếp theo quan sát được là:
A. khí hiđro thoát ra mạnh.
B. khí hiđro thoát ra sau đó dừng lại ngay.
C. lá nhôm bốc cháy.
D. lá nhôm tan ngay trong thủy ngân và không có phản ứng.
Lời giải:
Câu 2. Cho 2,7 gam Al tác dụng hoàn toàn với dung dịch NaOH dư. Sau khi phản ứng kết thúc, thể tích khí H2 (ở đktc) thoát ra là (Cho Al = 27)
A. 4,48 lít.
B. 2,24 lít.
C. 6,72 lít.
D. 3,36 lít.
Lời giải:
Phương trình phản ứng
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
nAl = 0,1 => nH2 = 0,15 mol
=> V = 3,36 lít
Câu 3. Cho m gam Al vào 100ml dung dịch chứa Cu(NO3)2 0,5M và AgNO3 0,3M. Sau khi phản ứng kết thúc, thu được 1 chất rắn nặng 5,16 gam. Giá trị của m là
A. 0,81
B. 0,96
C. 0,48
D. 0,24
Lời giải:
Theo bài ra, ta có số mol: nAg+=0.03; nCu2+= 0.05A
Al + 3Ag+ → 3Ag + Al3+
0.01−−0.03−−0.03
2Al + 3Cu2+ → 2Al3+ + 3Cu
x−−−−−−−−−−−−−−−− 1.5x
xét mAg = 3.24 < 5.16 < 6.44 = mCu + mAg nên Ag phản ứng hết còn Cu phản ứng một phần
=> 0.03 ∗ 108 + 1.5x ∗ 64 = 5.16 <=> x = 0.02
m = 27.(0.02+0.01) = 0.81
Xem thêm các phương trình hóa học khác:
Xem thêm các chương trình khác:
- Các dạng bài tập Tiếng Anh thông dụng nhất
- 3000 câu hỏi ôn tập môn Tiếng Anh có đáp án
- Toàn bộ kiến thức về cụm động từ | Định nghĩa và cách dùng
- 500 đoạn văn Tiếng Anh thông dụng nhất và cách làm
- 1000 câu hỏi ôn tập môn Công nghệ có đáp án
- 1000 câu hỏi ôn tập Giáo dục công dân
- 15000 câu hỏi ôn tập môn Toán có đáp án
- Wiki Toán | Khái niệm, định lí, tính chất, dạng bài, công thức
- Tuyển tập đề thi + chuyên đề ôn thi Toán Kangaroo các cấp độ (có đáp án 2024)
- 3000 câu hỏi ôn tập môn Vật lí có đáp án
- Tổng hợp Dạng bài - Công thức môn Vật lí
- 2000 câu hỏi ôn tập môn Tin học có đáp án
- 3000 câu hỏi ôn tập môn Lịch sử có đáp án
- 3000 câu hỏi ôn tập môn Địa lí có đáp án
- 2000 câu hỏi ôn tập môn Sinh học có đáp án
- Tổng hợp Dạng bài - Công thức môn Sinh học
- Tổng hợp về các tác giả văn học
- 3000 câu hỏi ôn tập môn Ngữ văn có đáp án
- Tổng hợp kiến thức Ngữ Văn
- Trò chơi Powerpoint | Game Powerpoint
- Tổng hợp bài thu hoạch BDTX Giáo viên mầm non (2024) theo Thông tư 12
- Tổng hợp bài thu hoạch BDTX Giáo viên tiểu học (2024)
- Tổng hợp bài thu hoạch BDTX Giáo viên THCS (2024)
- Tổng hợp bài thu hoạch BDTX Giáo viên THPT (2024)