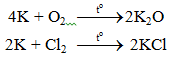K + PbSO4 + H2O → K2SO4 + H2 + Pb(OH)2 l K ra K2SO4
K + PbSO4 + H2O → K2SO4 + H2 + Pb(OH)2 là phản ứng oxi hóa khử. Bài viết này cung cấp đầy đủ thông tin về phương trình hóa học đã được cân bằng, điều kiện các chất tham gia phản ứng, hiện tượng (nếu có), ... Mời các bạn đón xem:
Phản ứng K + PbSO4 + H2O → K2SO4 + H2 + Pb(OH)2
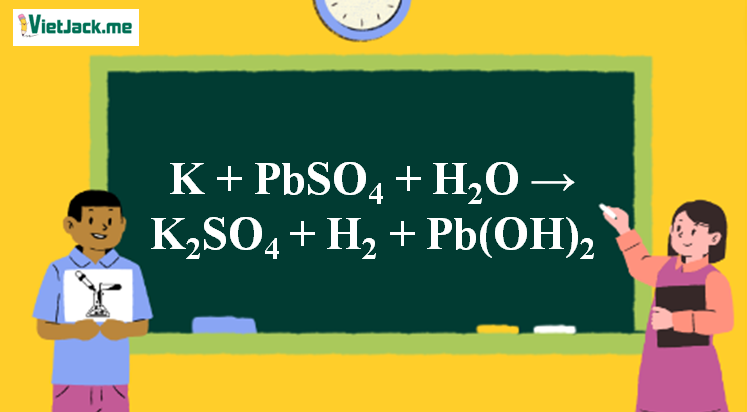
1. Phản ứng hóa học
2K + PbSO4 + 2H2O → 3K2SO4 + H2 + Pb(OH)2
2. Điều kiện phản ứng
Không cần điều kiện
3. Cách thực hiện phản ứng
Cho kali tác dụng với dung dịch muối chì sunfat
4. Hiện tượng nhận biết phản ứng
Kali tan dần trong dung dịch muối chì, có kết tủa màu trắng tạo thành và có khí thoát ra.
5. Bản chất của K (Kali) trong phản ứng
- Trong phản ứng trên K là chất khử.
- K là chất khử mạnh, K tham gia phản ứng với các dung dịch muối như Cr3+; Al3+; Zn2+ thì nếu K dư sẽ hòa tan được kết tủa tạo thành.
6. Tính chất hoá học của K
Kali là kim loại kiềm có tính khử rất mạnh.
K → K+ + 1e
6.1. Tác dụng với phi kim
6.2. Tác dụng với axit
2K + 2HCl → 2KCl + H2.
6.3. Tác dụng với nước
K tác dụng mãnh liệt với nước và tự bùng cháy tạo thành dung dịch kiềm và giải phóng khí hidro.
2K + 2H2O → 2KOH + H2.
6.4. Tác dụng với hidro
Kali tác dụng với hidro ở áp suất khá lớn và nhiệt độ khoảng 350 – 400oC tạo thành kali hidrua.
2K (lỏng) + H2 (khí) → 2KH (rắn)
7. Mở rộng kiến thức về PbSO4
7.1. Tính chất vật lí & nhận biết
- Tính chất vật lí: Là chất rắn, có màu trắng, không tan trong nước, có tính độc .
- Nhận biết: Nung nóng ở nhiệt độ cao, chuyển từ chất rắn màu trắng sang vàng hoặc đỏ:
PbSO4 
7.2. Tính chất hóa học
Hòa tan trong HNO3, HCl, H2SO4:
PbSO4+ H2SO4→ Pb(HSO4)2
PbSO4+ 4NaOH→ Na2[Pb(OH)6] + Na2SO4
Chì(II) sunfat bị phân hủy khi nung trên 1000oC:
PbSO4 
7.3. Điều chế
Chì(II) sunfat được điều chế bằng cách xử lý chì oxit, hidroxit hoặc cacbonat với axit sulnuric nóng
PbO + H2SO4→ PbSO4 + H2O
Pb(OH)2 + H2SO4 → PbSO4 + 2H2O
7.4. Ứng dụng
Chì(II) sunfat ít có ứng dụng do có tính độc cao, gây độc hại khi hít phải, ăn mòn và tiếp xúc với da. Đó là một chất độc tích lũy và tiếp xúc lặp lại có thể dẫn đến thiếu máu, hư thận, tổn thương thị lực hoặc làm hư hệ thần kinh trung ương (đặc biệt ở trẻ em). Nó cũng ăn mòn khi tiếp xúc với mắt có thể dẫn đến kích ứng nghiêm trọng hoặc bỏng.
8. Câu hỏi vận dụng
Câu 1. Kim loại nào sau đây có cấu hình 1s22s22p63s1:
A. Na B. K
C. Al D. Mg
Lời giải:
Đáp án B
Câu 2. Khi cho kim loại K dư vào dung dịch PbSO4 thì sẽ xảy ra hiện tượng
A. ban đầu có xuất hiện kết tủa trắng, sau đó kết tủa tan ra, dung dịch trong suốt.
B. ban đầu có sủi bọt khí, sau đó xuất hiện kết tủa xanh.
C. ban đầu có sủi bọt khí, sau đó có tạo kết tủa trắng, rồi kết tủa tan ra, dd trong suốt.
D. chỉ có sủi bọt khí.
Lời giải:
Đáp án C
Phương trình hóa học: 2K + PbSO4 + 2H2O → 3K2SO4 + H2 + Pb(OH)2
Câu 3. Cho K tác dụng với 100 ml dung dịch muối chì sunfat 0,1 M thu được kết tủa X. Khối lượng kết tủa thu được là:
A. 2,41 g B. 1,205 g
C. 0,241 g D. 4,82 g
Lời giải:
Đáp án A
Phương trình hóa học: 2K + PbSO4 + 2H2O → 3K2SO4 + H2 + Pb(OH)2
nPb(OH)2 = nPbSO4 = 0,1.0,1 = 0,01 mol ⇒ mPb(OH)2 = 241.0,01 = 2,41 g
Xem thêm các phương trình phản ứng hóa học khác:
K + Fe2(SO4)3 + H2O → K2SO4 + H2 + Fe(OH)3
K + CuCl2 + H2O → KCl + H2 + Cu(OH)2
K + FeCl2 + H2O → KCl + H2 + Fe(OH)2
Xem thêm các chương trình khác:
- Các dạng bài tập Tiếng Anh thông dụng nhất
- 3000 câu hỏi ôn tập môn Tiếng Anh có đáp án
- Toàn bộ kiến thức về cụm động từ | Định nghĩa và cách dùng
- 500 đoạn văn Tiếng Anh thông dụng nhất và cách làm
- 1000 câu hỏi ôn tập môn Công nghệ có đáp án
- 1000 câu hỏi ôn tập Giáo dục công dân
- 15000 câu hỏi ôn tập môn Toán có đáp án
- Wiki Toán | Khái niệm, định lí, tính chất, dạng bài, công thức
- Tuyển tập đề thi + chuyên đề ôn thi Toán Kangaroo các cấp độ (có đáp án 2024)
- 3000 câu hỏi ôn tập môn Vật lí có đáp án
- Tổng hợp Dạng bài - Công thức môn Vật lí
- 2000 câu hỏi ôn tập môn Tin học có đáp án
- 3000 câu hỏi ôn tập môn Lịch sử có đáp án
- 3000 câu hỏi ôn tập môn Địa lí có đáp án
- 2000 câu hỏi ôn tập môn Sinh học có đáp án
- Tổng hợp Dạng bài - Công thức môn Sinh học
- Tổng hợp về các tác giả văn học
- 3000 câu hỏi ôn tập môn Ngữ văn có đáp án
- Tổng hợp kiến thức Ngữ Văn
- Tuyển tập truyện dân gian, truyền thuyết, cổ tích,... Việt Nam
- Trò chơi Powerpoint | Game Powerpoint
- Tổng hợp bài thu hoạch BDTX Giáo viên mầm non (2025) theo Thông tư 12
- Tổng hợp bài thu hoạch BDTX Giáo viên tiểu học (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THCS (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THPT (2025)