P2O5 + H2O → H3PO4 | P2O5 ra H3PO4
P2O5 + H2O → H3PO4 là phản ứng hóa hợp. Bài viết này cung cấp đầy đủ thông tin về phương trình hóa học đã được cân bằng, điều kiện các chất tham gia phản ứng, hiện tượng (nếu có), ... Mời các bạn đón xem:
Phản ứng P2O5 + H2O → H3PO4
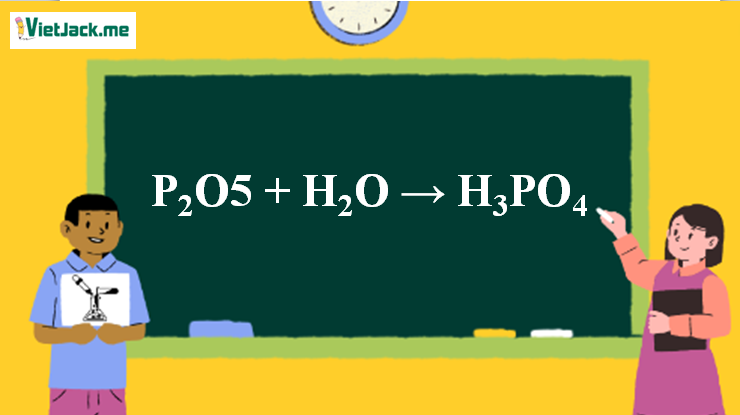
1. Phương trình phản ứng P2O5 tác dụng H2O
P2O5 + 3H2O → 2H3PO4
2. Điều kiện phản ứng P2O5 tác dụng với nước
Không có
3. Cách thực hiện phản ứng P2O5 tác dụng với nước
Cho P2O5 tác dụng với nước.
4. Hiện tượng nhận biết phản ứng P2O5 tác dụng với nước
Chất rắn màu trắng Điphotpho pentaoxit (P2O5) tan dần. Dung dịch axit H3PO4 làm đổi màu giấy quỳ tím thành đỏ.
5. Thông tin mở rộng về P2O5
5.1. Tính chất vật lý P2O5
Là chất khói trắng, không mùi, háo nước và dễ chảy rữa thường dùng để làm khô các chất.
5.2. Tính chất hoá học P2O5
Tác dụng với dung dịch kiềm, tùy theo tỉ lệ có thể tạo thành các muối khác nhau:
P2O5 + 2NaOH + H2O → 2NaH2PO4
P2O5 + 4NaOH → 2Na2HPO4 + H2O
P2O5 + 6NaOH→ 2Na3PO4 + 3H2O
Tác dụng với nước
P2O5+ 3H2O → 2H3PO4(axit photphoric)
P2O5 + H2O → 2HPO3 (axit metaphotphoric)
5.3. Điều chế P2O5
4P + 5O2→ 2P2O5
5.4. Ứng dụng P2O5
Công dụng chính của Tripoly P2O5 là được sử dụng làm chất hút ẩm cho chất lỏng và khí. Ngoài ra nó còn được dùng trong quá trình tổng hợp hữu cơ.
Trong quy trình sản xuất andehyt thì nó lại được kết hợp cùng với axit cacboxylic.
Một ứng dụng khác của Tripoly là làm phân bón trong sản xuất nông lâm nghiệp như phân lân photphat.
6. Tính chất hóa học của H2O
6.1. Nước tác dụng với kim loại
Ở điều kiện thường, nước có thể phản ứng với các kim loại mạnh như Li, Ca, Na, K, Ba,… để tạo thành dung dịch Bazo và khí Hidro.
H2O + Kim loại → Bazơ + H2↑
2M + 2nH2O → 2M(OH)n + nH2↑
2Na + 2H2O → 2NaOH + H2
2K + 2H2O → 2KOH + H2
Ca + 2H2O → Ca(OH)2 + H2
Ba + 2H2O → Ba(OH)2 + H2
Đặc biệt, một số kim loại trung bình như Mg, Zn, Al, Fe,…phản ứng được với hơi nước ở nhiệt độ cao tạo ra oxit kim loại và hidro. Bên cạnh đó, kim loại Mg tan rất chậm trong nước nóng.
6.2. Nước tác dụng với oxit bazo
Nước tác dụng với một số oxit bazo như Na2O, CaO , K2O,… tạo thành dung dịch bazo tương ứng. Dung dịch bazo làm cho quỳ tím hóa xanh.
H2O + Oxit bazơ → Bazơ
Na2O + H2O → 2NaOH
Li2O + H2O→ 2LiOH
K2O + H2O→ 2KOH
CaO + H2O → Ca(OH)2
6.3. Nước tác dụng với oxit axit
Nước tác dụng với oxit axit tạo thành axit tương ứng. Dung dịch axit làm quỳ tím hóa đỏ.
H2O + Oxit axit → Axit
CO2 + H2O → H2CO3
SO2 + H2O → H2SO3
P2O5 + 3H2O → 2H3PO4
SO3 + H2O → H2SO4
N2O5 + H2O → 2HNO3
7. Bài tập vận dụng
Câu 1. Cho a gam P2O5 tác dụng với 507 ml dung dịch NaOH 2M, sau khi các phản ứng xảy ra hoàn toàn thu được dung dịch A. Cô cạn dung dịch A thu được 6a gam chất rắn. Giá trị của a là:
A. 21,3
B. 8,52
C.12,78
D. 17,04
Lời giải:
Đáp án: D
Giải thích:
Xét trường hợp 1:
P2O5và NaOH pứ vừa đủ tạo muối:
nH2O = nNaOH = 1,014 mol.
P2O5+ H2O → 2H3PO4
a/142 → 2a/142 mol
Có thể xảy ra các phương trình hóa học sau:
H3PO4 + NaOH → NaH2PO4+ H2O (3)
H3PO4 + 2NaOH → Na2HPO4+ 2H2O (4)
H3PO4 + 3NaOH → Na3PO4+ 3H2O (5)
Áp dụng bảo toàn khối lượng ta có:
mH3PO4 + mNaOH= mrắn + mH2O
(2a/142).98 + 1,014.40 = 6a + 1,014.18
→ a = 13,772 gam (loại).
Trường hợp 2: Chất rắn gồm: NaOH dư; Na3PO4
P2O5 + 6NaOH→ 2Na3PO4 + 3H2O
a/142 1,014 2a/142 3a/142
Áp dụng bảo toàn khối lượng:
mP2O5 + mNaOHbđ = mrắn + mH2O
a + 0.507.2.40 = 3a + 18.6a/142 => a = 17,04 gam.
Câu 2. Đốt hoàn toàn m gam photpho trong oxi dư, rồi cho sản phẩm tác dụng với dung dịch NaOH dư, thu được 41,0 gam muối. Giá trị của m là
A. 7,75
B. 31,0
C. 15,5
D. 46,5
Lời giải:
Đáp án: A
Giải thích:
Phương trình phản ứng xảy ra
4P + 5O2 → 2P2O5
P2O5+ 6NaOH dư → 2Na3PO4 + 3H2O
=> nNa3PO4 = 41/164 = 0,25 (mol)
Bảo toàn nguyên tố P ta có
nP = nNa3PO4 = 0,25 (mol)
=> mP = 0,25.31 = 7,75 (gam)
Câu 3. Cho 7,1 gam P2O5 vào 100 ml dung dịch NaOH 1,5M thu được dung dịch X. Cô cạn dung dịch X được hỗn hợp gồm các chất là
A. NaH2PO4 và H3PO4.
B. NaH2PO4và Na2HPO4.
C. NaH2PO4 và Na3PO4.
D. Na3PO4 và Na2HPO4.
Lời giải:
Đáp án: B
Giải thích:
Ta có
nP2O5 = 0,05 mol;
nNaOH= 0,15 mol = 3nP2O5
=> Phản ứng tạo ra 2 muối là NaH2PO4 và Na2HPO4
Phương trình phản ứng
P2O5 + 2NaOH + H2O → 2NaH2PO4
P2O5 + 4NaOH → 2Na2HPO4 + H2O
Câu 4. Trộn 3 dung dịch HCl 0,3M; H2SO4 0,2M; và H3PO4 0,1M với những thể tích bằng nhau thu được dung dịch A. Để trung hòa 300 ml dung dịch A cần vừa đủ V ml dung dịch B gồm NaOH 0,2M và Ba(OH)20,1M. Giá trị của V là
A. 250.
B. 200.
C. 500.
D. 550.
Lời giải:
Đáp án: B
Giải thích:
Thể tích mỗi axit là 100ml
nH+ = nHCl + 2nH2SO4+ 3nH3PO4= 0,1.0,3+ 2.0,2.0,1+ 3.0,1.0,1 = 0,1 mol
nOH-= (V.0,1+2.0,2.V)/1000 mol
H+ + OH- → H2O
Theo phương trình: nH+= nOH-
nên 0,1= (V.0,1 + 2.0,2.V)/1000 suy ra V= 200 ml
Câu 5. Cho 300 ml dung dịch KOH 1M tác dụng với 400 ml dung dịch H3PO4 0,5M. Sau phản ứng, trong dung dịch chứa các muối
A. KH2PO4 và K2HPO4.
B. KH2PO4 và K3PO4.
C. K2HPO4 và K3PO4.
D. KH2PO4, K2HPO4và K3PO4
Lời giải:
Đáp án: A
Giải thích:
Ta có: nKOH = 0,3 (mol); nH3PO4 = 0,2 (mol)
Ta thấy: 1 < nKOH/nH3PO4= 0,3/0,2 = 1,5 < 2 → Tạo muối KH2PO4 và K2HPO4
Câu 6. Cho 22 gam NaOH vào dung dịch chứa 19,6 gam H3PO4. Sau khi phản ứng xảy ra hoàn toàn, đem cô cạn dung dịch. Khối lượng từng muối khan thu được là
A. 50 gam Na3PO4.
B. 7,1 gam Na2HPO4 và 24,6 gam Na3PO4.
C. 15 gam NaH2PO4.
D. 24,6 gam Na2HPO4 và 49,2 gam Na3PO4.
Lời giải:
Đáp án: B
Giải thích:
nNaOH = 22/40 = 0,55 mol;
nH3PO4 = 19,6/98 = 0,2 mol
Ta có: 2< nNaOH/nH3PO4 = 0,55/0,2 = 2,75 < 3 phản ứng sinh ra 2 muối là Na2HPO4 (x mol) và Na3PO4 (y mol)
Phương trình hóa học
2NaOH + H3PO4 → Na2HPO4 + 2H2O
2x ← x ← x
3NaOH + H3PO4→ Na3PO4 + 3H2O
3y ← y ← y
nNaOH = 2x + 3y = 0,55 (1)
nH3PO4 = x + y = 0,2 (2)
Từ (1) và (2) → x = 0,05; y = 0,15
mNa2HPO4= 0,05.142 = 7,1 gam
mNa3PO4= 0,15.164 = 24,6 gam
→ mmuối = 7,1 + 24,6 = 31,7 gam
Câu 7. Nhận xét nào sau đây đúng ?
A. Thành phần chính của quặng apatit là 3Ca3(PO4)2, CaF2.
B. Trong công nghiệp photpho được điều chế từ Ca3P2, SiO2 và C.
C. Ở điều kiện thường photpho đỏ tác dụng với O2 tạo ra sản phẩm P2O5.
D. Các muối Ca3(PO4)2 và CaHPO4 đều tan trong nước.
Lời giải:
Đáp án: A
Giải thích:
A. Thành phần chính của quặng apatit là 3Ca3(PO4)2, CaF2.
Câu 8. Khi đổ KOH đến dư vào dd H3PO4, sau phản ứng xảy ra hoàn toàn thu được muối
A. K3PO4 và K2HPO4
B. KH2PO4
C. K3PO4
D. K3PO4 và KH2PO4
Lời giải:
Đáp án: C
Câu 9. Câu trả lời nào dưới đây không đúng khi nói về axit photphoric?
A. Axit photphoric là axit có độ mạnh trung bình
B. Axit photphoric là axit ba nấc.
C. Axit photphoric có tính oxi hóa rất mạnh.
D. Axit photphoric làm quỳ tím chuyển màu đỏ.
Lời giải:
Đáp án: C
Giải thích:
Axit phophoric là axit 3 nấc, có độ mạnh trung bình, có thể làm quỳ tím hóa đỏ và có tính oxi hóa trung bình
Câu 10. Chỉ ra các oxit bazo: P2O5, CaO, CuO, BaO, Na2O, P2O3
A. P2O5, CaO, CuO
B. CaO, CuO, BaO, Na2O
C. BaO, Na2O, P2O3
D. P2O5, CaO, P2O3
Lời giải:
Đáp án: B
Câu 11: Chỉ ra oxit axit: P2O5, CaO, CuO, BaO, SO2, CO2
A. P2O5, CaO, CuO, BaO
B. BaO, SO2, CO2
C. CaO, CuO, BaO
D. SO2, CO2 , P2O5
Lời giải:
Đáp án: D
Câu 12: Chọn đáp án đúng
A. CO- cacbon (II) oxit
B. CuO- đồng (II) oxit
C. FeO- sắt (III) oxit
D. CaO- canxi trioxit
Lời giải:
Đáp án: B
Câu 13: Axit tương ứng của CO2
A. H2SO4
B. H3PO4
C. H2CO3
D. HCl
Lời giải:
Đáp án: C
Câu 14: Bazo tương ứng của MgO
A. Mg(OH)2
B. MgCl2
C. MgSO4
D. Mg(OH)3
Lời giải:
Đáp án: A
Câu 15: Tên gọi của P2O5
A. Điphotpho trioxit
B. Photpho oxit
C. Điphotpho oxit
D. Điphotpho pentaoxit
Lời giải:
Đáp án: D
Câu 16. Phản ứng giữa cặp chất nào sau đây không xảy ra?
A. Dung dịch bari hiđroxit và dung dịch axit clohiđric
B. Dung dịch đồng (II) sunfat và dung dịch natri hiđroxit
C. Dung dịch natri cacbonat và dung dịch kali clorua
D. Dung dịch bari clorua và dung dịch natri sunfat
Lời giải:
Đáp án: C
Giải thích:
Ba(OH)2 + 2HCl → BaCl2 + H2O
CuSO4 + NaOH → Cu(OH)2 + Na2SO4
BaCl2 + Na2SO4→ BaSO4 + NaCl
Câu 17. Phản ứng giữa cặp chất nào sau đây tạo ra sản phẩm có chất khí?
A. Dung dịch natri hiđroxit và dung dịch axit sunfuric
B. Dung dịch natri cacbonat và dung dịch bari hiđroxit
C. Dung dịch bari clorua và dung dịch natri sunfat
D. Dung dịch natri sunfit và dung dịch axit clohiđric
Lời giải:
Đáp án: D
Giải thích:
Phương trình hóa học.
Na2SO3 + 2HCl → 2NaCl + H2O + SO2
Câu 18. Hấp thụ hoàn toàn 11,2 lít khí CO2 (đktc) bằng một dung dịch chứa 20 g NaOH. Muối được tạo thành là:
A. Na2CO3.
B. NaHCO3.
C. Hỗn hợp Na2CO3 và NaHCO3.
D. Na(HCO3)2.
Lời giải:
Đáp án: B
Giải thích:
nCO2= 11,2/22,4 = 0,5 mol;
nNaOH = 20/ 40 = 0,5 mol
T = nNaOH/nCO2 = 0,5/0,5 = 1 mol
Sau phản ứng thu được muối NaHCO3
Câu 19. Hoà tan 6,2 g natri oxit vào 193,8 g nước thì được dung dịch A. Nồng độ phần trăm của dung dịch A là:
A. 4%.
B. 6%.
C. 4,5%
D. 10%
Lời giải:
Đáp án: A
Giải thích:
nNa2O = mNa2O/MNa2O =6,22/(23 + 16) = 0,1 (mol)
Phương trình hóa học:
Na2O + H2O → 2NaOH
0,1 0,1 0,2
Theo phương trình hóa học:: nNaOH = 2nNa2O = 2.0,1 = 0,2 (mol)
⟹ mNaOH = nNaOH. MNaOH = 0,2.40 = 8 (g)
Khối lượng dung dịch sau là: mdd sau = mNa2O + mH2O = 6,2 + 193,8 = 200 (g)
Dung dịch A thu được là dung dịch NaOH
Nồng độ phần trăm C%NaOH = mNaOH/mddsau.100% = 8/200.100% = 4 %
Câu 20. Dãy các chất tác dụng với lưu huỳnh đioxit là:
A. Na2O, CO2, NaOH, Ca(OH)2
B. CaO, K2O, KOH, Ca(OH)2
C. HCl, Na2O, Fe2O3, Fe(OH)3
D. Na2O, CuO, SO3, CO2
Lời giải:
Đáp án: B
Giải thích:
CaO + SO2 → CaSO3
K2O + SO2 → K2SO3
KOH + SO2 → K2SO3 + H2O
Ca(OH)2 + SO2 → CaSO3 + H2O
Câu 21. Để nhận biết 3 khí không màu: SO2, O2, H2 đựng trong 3 lọ mất nhãn ta dùng:
A . Giấy quỳ tím ẩm
B . Giấy quỳ tím ẩm và dùng que đóm cháy dở còn tàn đỏ
C . Than hồng trên que đóm
D . Dẫn các khí vào nước vôi trong
Lời giải:
Đáp án: B
Giải thích:
Giấy quỳ tím ẩm thì nhận biết được SO2 do SO2 tan trong nước tạo dung dịch axit làm quỳ tím hóa đỏ
Dùng que đóm cháy dở còn tàn đỏ nhận biết được khí O2 vì Oxi là chất duy trì sự sống và cháy nên sẽ quan sát được hiện tượng là tàn đóm bùng cháy
Xem thêm các phương trình phản ứng hóa học khác:
Xem thêm các chương trình khác:
- Các dạng bài tập Tiếng Anh thông dụng nhất
- 3000 câu hỏi ôn tập môn Tiếng Anh có đáp án
- Toàn bộ kiến thức về cụm động từ | Định nghĩa và cách dùng
- 500 đoạn văn Tiếng Anh thông dụng nhất và cách làm
- 1000 câu hỏi ôn tập môn Công nghệ có đáp án
- 1000 câu hỏi ôn tập Giáo dục công dân
- 15000 câu hỏi ôn tập môn Toán có đáp án
- Wiki Toán | Khái niệm, định lí, tính chất, dạng bài, công thức
- Tuyển tập đề thi + chuyên đề ôn thi Toán Kangaroo các cấp độ (có đáp án 2024)
- 3000 câu hỏi ôn tập môn Vật lí có đáp án
- Tổng hợp Dạng bài - Công thức môn Vật lí
- 2000 câu hỏi ôn tập môn Tin học có đáp án
- 3000 câu hỏi ôn tập môn Lịch sử có đáp án
- 3000 câu hỏi ôn tập môn Địa lí có đáp án
- 2000 câu hỏi ôn tập môn Sinh học có đáp án
- Tổng hợp Dạng bài - Công thức môn Sinh học
- Tổng hợp về các tác giả văn học
- 3000 câu hỏi ôn tập môn Ngữ văn có đáp án
- Tổng hợp kiến thức Ngữ Văn
- Tuyển tập truyện dân gian, truyền thuyết, cổ tích,... Việt Nam
- Tổng hợp các đề đọc - hiểu có đáp án chi tiết
- Trò chơi Powerpoint | Game Powerpoint
- Tổng hợp bài thu hoạch BDTX Giáo viên mầm non (2025) theo Thông tư 12
- Tổng hợp bài thu hoạch BDTX Giáo viên tiểu học (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THCS (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THPT (2025)
