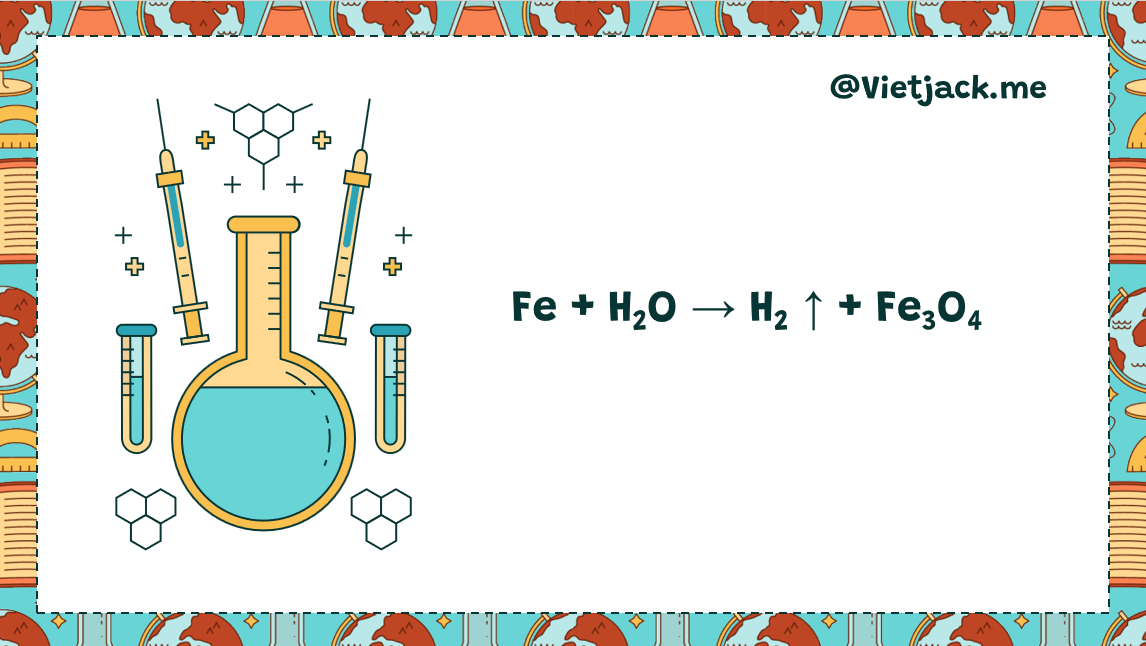
Fe + H2O → H2 ↑ + Fe3O4 | Fe ra Fe3O4
Phản ứng hóa học: Fe + H2O hay Fe ra Fe3O4 thuộc loại phản ứng oxi hóa khử đã được cân bằng chính xác và chi tiết nhất. Bên cạnh đó là một số bài tập có liên quan về Fe có lời giải, mời các bạn đón xem
Phản ứng Fe + H2O → H2 ↑ + Fe3O4
1. Phương trình hoá học của phản ứng Fe tác dụng với H2O
3Fe + 4H2O to<570oC→ Fe3O4 + 4H2
Cách lập phương trình hoá học:
Bước 1: Xác định các nguyên tử có sự thay đổi số oxi hoá, từ đó xác định chất oxi hoá – chất khử:
0Fe++1H2O→t°
Chất khử: Fe; chất oxi hoá: H2O.
Bước 2: Biểu diễn quá trình oxi hoá, quá trình khử
- Quá trình oxi hoá:
- Quá trình khử:
Bước 3: Tìm hệ số thích hợp cho chất khử và chất oxi hoá
Bước 4: Điền hệ số của các chất có mặt trong phương trình hoá học. Kiểm tra sự cân bằng số nguyên tử của các nguyên tố ở hai vế.
3Fe + 4H2O Fe3O4 + 4H2
2. Điều kiện để Fe tác dụng với H2O
Phản ứng giữa sắt và H2O diễn ở điều kiện đun nóng ở nhiệt độ cao.
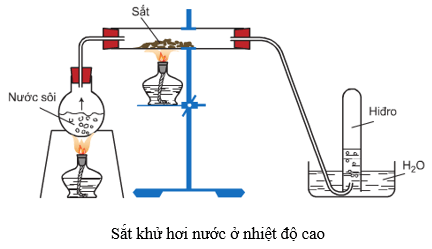
3. Cách tiến hành thí nghiệm
Cho hơi nước đi qua ống nghiệm chứa sắt đang nung nóng.
4. Hiện tượng phản ứng
Có khí hiđro thoát ra khỏi dung dịch, chất rắn tạo thành có màu đen
5. Tính chất hóa học của sắt
Sắt là kim loại có tính khử trung bình. Khi tác dụng với chất oxi hóa yếu, sắt bị oxi hóa đến số oxi hóa +2.
Fe → + 2e
Với chất oxi hóa mạnh, sắt bị oxi hóa đến số oxi hóa +3.
Fe → + 3e
5.1. Tác dụng với phi kim
Ở nhiệt độ cao, sắt khử nguyên tử phi kim thành ion âm và bị oxi hóa đến số oxi hóa +2 hoặc +3.
+ Tác dụng với lưu huỳnh:
+ Tác dụng với oxi:
+ Tác dụng với clo:
5.2. Tác dụng với axit
- Với dung dịch HCl, H2SO4 loãng, Fe bị oxi hóa đến số oxi hóa +2, giải phóng H2. Ví dụ:
Fe + H2SO4 → FeSO4 + H2
- Với dung dịch HNO3 và H2SO4 đặc nóng, Fe bị oxi hóa đến số oxi hóa +3, và không giải phóng H2. Ví dụ:
Fe + 4HNO3 loãng → Fe(NO3)3 + NO + 2H2O
Chú ý: Fe bị thụ động bởi các axit HNO3 đặc, nguội và H2SO4 đặc, nguội.
5.3. Tác dụng với dung dịch muối
Fe có thể khử được ion của các kim loại đứng sau nó trong trong dãy điện hóa của kim loại. Trong các phản ứng này, Fe thường bị oxi hóa đến số oxi hóa +2. Ví dụ:
Fe + CuSO4 → FeSO4 + Cu
Đặc biệt:
Fe + 2Ag+ → Fe2+ + 2Ag
Nếu Ag+ dư, tiếp tục có phản ứng:
Fe2+ + Ag+ → Fe3+ + Ag
5.4. Tác dụng với nước
Ở nhiệt độ thường, sắt không khử được nước, nhưng ở nhiệt độ cao, sắt khử hơi nước tạo ra H2 và Fe3O4 hoặc FeO.
3Fe + 4H2O Fe3O4 + 4H2
Fe + H2O FeO + H2
6. Tính chất vật lí của Fe
- Màu xám hơi trắng, dễ ràn và dẻo cũng như có thể dát mỏng hay kéo sợi, khả năng dẫn điện và nhiệt không bằng nhôm hay đồng.
- Nhiễm từ ở nhiệt độ cao khoảng 800 độ C sẽ nhiễm từ và mất từ tính.
7. Bài tập liên quan
Câu 1: Cho 11,2 gam Fe tác dụng hết với dung dịch H2SO4 loãng dư , thu được V lít khí H2 (đktc). Giá trị của V là
A. 2,24 B. 3,36 C. 4,48 D. 6,72
Hướng dẫn giải
Đáp án C
Áp dụng định luật bảo toàn electron:
2.nFe = 2.
→ = nFe = 0,2 mol
→ V = 0,2.22,4 = 4,48 lít
Câu 2:Trong 3 chất Fe, Fe2+, Fe3+. Chất X chỉ có tính khử, chất Y chỉ có tính oxi hoá, chất Z vừa có tính khử vừa có tính oxi hóa. Các chất X, Y, Z lần lượt là:
A. Fe, Fe2+ và Fe3+.B. Fe2+, Fe và Fe3+.
C. Fe3+, Fe và Fe2+. D. Fe, Fe3+ và Fe2+.
Hướng dẫn giải
Đáp án D
+) Fe đơn chất có số oxi hóa bằng 0 → có khả nhường 2e hoặc 3e → chỉ có tính khử → X là Fe
+) Fe2+ có khả năng nhường 1e để thành Fe3+ → có tính khử
Fe2+ có khả năng nhận 2e để thành Fe đơn chất → có tính oxi hóa
→ Z là Fe2+
+) Fe3+ chỉ có khả năng nhận 1e để trở thành Fe2+ hoặc nhận 3e để thành Fe đơn chất → Fe3+ chỉ có tính oxi hóa → Y là Fe3+
Câu 3: Cho 2,24 gam Fe tác dụng với oxi, thu được 3,04 gam hỗn hợp X gồm 2 oxit. Để hoà tan hết X cần thể tích dung dịch HCl 2M là
A. 25 ml. B. 50 ml. C. 100 ml. D. 150 ml.
Hướng dẫn giải
Đáp án B
Áp dụng định luật bảo toàn khối lượng
mFe + mO = m oxit
→ 2,24 + mO = 3,04
→ mO = 0,8 gam
→ nO = 0,05 mol
Áp dụng bảo toàn nguyên tố
Oxit + HCl → muối clorua + H2O
nHCl = nH (axit) = 2. = 2.nO = 2.0,05 = 0,1 mol
→ Vdd HCl 2M = = 0,05 lít = 50 ml
Câu 4: Nung nóng 16,8 gam bột sắt ngoài không khí, sau một thời gian thu được m gam hỗn hợp X gồm các oxit sắt và sắt dư. Hòa tan hết hỗn hợp X bằng H2SO4 đặc nóng thu được 5,6 lít SO2(đkc). Giá trị của m là:
A.24 gam B. 26 gam C. 20 gam D. 22 gam
Hướng dẫn giải
Đáp án C
Quy đổi hỗn hợp X về hỗn hợp gồm (Fe, O)
nFe = = 0,3 mol
Bảo toàn electron cho phản ứng hòa tan X và dung dịch H2SO4
→ 3.nFe = 2.nO + 2.
→ 3.0,3 = 2.nO + 2.0,25
→ nO = 0,2 mol
→ mX = 56.0,3 + 16.0,2 = 20 gam
Câu 5: Đốt cháy hoàn toàn 16,8 gam Fe trong khí O2 cần vừa đủ 4,48 lít O2 (đktc) tạo thành một oxit sắt. Công thức phân tử của oxit đó là công thức nào sau đây?
A. FeO B. Fe2O3
C. Fe3O4 D. FeO hoặc Fe3O4
Hướng dẫn giải
Đáp án C
Đặt công thức phân tử của oxit sắt là FexOy
nFe = = 0,3 mol
= = 0,2 mol → nO = 0,2.2 = 0,4 mol
→ x : y = nFe : nO = 0,3 : 0,4 = 3 : 4
→ Công thức phân tử của oxit sắt là: Fe3O4
Xem thêm các chương trình khác:
- Các dạng bài tập Tiếng Anh thông dụng nhất
- 3000 câu hỏi ôn tập môn Tiếng Anh có đáp án
- Toàn bộ kiến thức về cụm động từ | Định nghĩa và cách dùng
- 500 đoạn văn Tiếng Anh thông dụng nhất và cách làm
- 1000 câu hỏi ôn tập môn Công nghệ có đáp án
- 1000 câu hỏi ôn tập Giáo dục công dân
- 15000 câu hỏi ôn tập môn Toán có đáp án
- Wiki Toán | Khái niệm, định lí, tính chất, dạng bài, công thức
- Tuyển tập đề thi + chuyên đề ôn thi Toán Kangaroo các cấp độ (có đáp án 2024)
- 3000 câu hỏi ôn tập môn Vật lí có đáp án
- Tổng hợp Dạng bài - Công thức môn Vật lí
- 2000 câu hỏi ôn tập môn Tin học có đáp án
- 3000 câu hỏi ôn tập môn Lịch sử có đáp án
- 3000 câu hỏi ôn tập môn Địa lí có đáp án
- 2000 câu hỏi ôn tập môn Sinh học có đáp án
- Tổng hợp Dạng bài - Công thức môn Sinh học
- Tổng hợp về các tác giả văn học
- 3000 câu hỏi ôn tập môn Ngữ văn có đáp án
- Tổng hợp kiến thức Ngữ Văn
- Tuyển tập truyện dân gian, truyền thuyết, cổ tích,... Việt Nam
- Tổng hợp các đề đọc - hiểu có đáp án chi tiết
- Trò chơi Powerpoint | Game Powerpoint
- Tổng hợp bài thu hoạch BDTX Giáo viên mầm non (2025) theo Thông tư 12
- Tổng hợp bài thu hoạch BDTX Giáo viên tiểu học (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THCS (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THPT (2025)