NaHCO3 + Na2CO3 → Na2HCO3 + NaCO3 | Na2CO3 ra Na2HCO3 | NaHCO3 ra NaCO3 | NaHCO3 ra Na2HCO3 | Na2CO3 ra Na2HCO3
NaHCO3 + Na2CO3 → Na2HCO3 + NaCO3 là phản ứng trao đổi. Bài viết này cung cấp đầy đủ thông tin về phương trình hóa học đã được cân bằng, điều kiện các chất tham gia phản ứng, hiện tượng (nếu có), ... Mời các bạn đón xem:
Phản ứng: NaHCO3 + Na2CO3 → Na2HCO3 + NaCO3
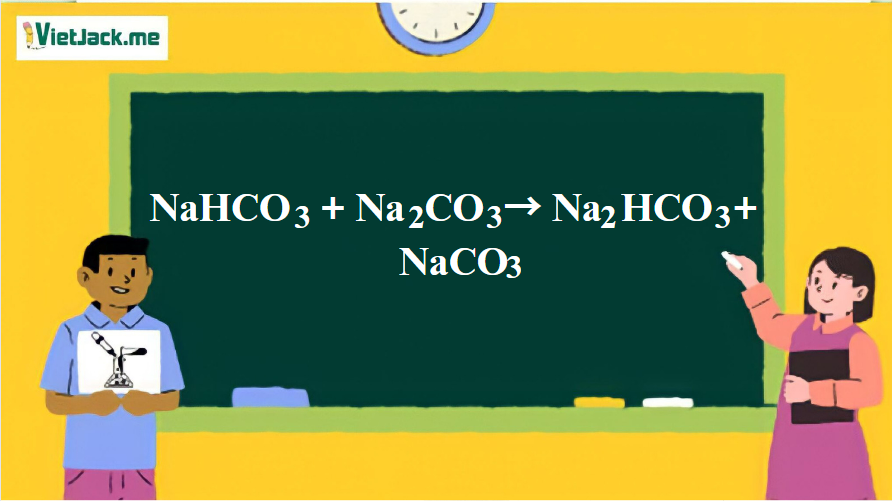
1. Phương trình phản ứng giữa NaHCO3 và Na2CO3
NaHCO3 + Na2CO3 → Na2HCO3 + NaCO3
2. Điều kiện xảy ra phản ứng hóa học
Nhiệt độ
3. Hiện tượng xảy ra sau khi phản ứng
Khi nhiệt phân NaHCO3 tạo thành muối Na2HCO3
4. Bản chất của các chất tham gia phản ứng
4.1 Bản chất của NaHCO3
NaHCO3 là một hợp chất lưỡng tính, vừa có tính axit vừa có tính bazơ.
4.2 Bản chất của Na2CO3
Na2CO3 là muối của axit cacbonic và natri. Nó hoà tan trong nước để tạo ra ion natri (Na+) và ion carbonate (CO32-).
5. Tính chất hóa học của NaHCO3
Natri Bicarbonat ít tan trong nước, trong dung dịch phân li hoàn toàn thành ion.
NaHCO3 → Na+ + HCO3-
Natri Bicarbonat bị phân huỷ ở 270 độ, tham gia phản ứng nhiệt phân tạo muối và giải phóng khí CO2.
2NaHCO3 (nhiệt độ)→ Na2CO3 +CO2↑ + H2O
Natri bicarbonat thuỷ phân trong môi trường kiềm yếu. Trường hợp này có thể dùng quỳ tím và metyl để nhận biết.
NaHCO3 + H2O ⇄ H2CO3 + NaOH
Natri bicarbonat là một hợp chất lưỡng tính, vừa có tính axit vừa có tính bazơ.
5.1 Tác dụng với các dung dịch kiềm (NaOH, KOH…). Đây là một ví dụ điển hình cho phản ứng trung hòa.
NaHCO3 + NaOH → Na2CO3 + H2O
2NaHCO3 + Ca(OH )2 → Na2CO3 + CaCO3 + H2O
NaHCO3 + Ca(OH)2 → NaOH + CaCO3 + H2O
5.2 Phản ứng của 2 muối axit với nhau: (muối axit mạnh sẽ đóng vai trò là axit; muối axit yếu sẽ đóng vai trò là bazơ)
NaHSO4 + NaHCO3 → Na2SO4 + CO2 + H2O
5.3 Tác dụng với axit: (muối của axit yếu phản ứng với axit mạnh tạo ra muối mới + axit yếu hơn)
HCl + NaHCO3 → NaCl + CO2 + H2O
5.4 Tác dụng với muối:
NaHCO3 + AlCl3 + H2O → NaCl + CO2 + Al(OH)3
NaHCO3 + FeCl3 + H2O → Fe(OH)3 + NaCl + CO2
5.5 Tác dụng với oxit axit:
NaHCO3 + SO2 → NaHSO3 + CO2
6. Tính chất hóa học của Na2CO3
- Natri cacbonat (Na2CO3) có thể phản ứng với HCl loãng để giải phóng cacbon đioxit.
Na2CO3 + 2HCl loãng → 2NaCl + H 2 O + CO 2
- Natri cacbonat (Na2CO3) hấp thụ carbon dioxide và nước để tạo ra natri hydro cacbonat–
Na2CO3 (bão hòa) + H 2 O + CO 2 → 2NaHCO3
- Phản ứng với hydro florua-
Na2CO3 + 2HF → 2NaF + H 2 O + CO 2
7. Tính chất vật lí của Na2CO3
Na2CO3 khan là chất bột màu trắng, hút ẩm và nóng chảy ở 851 ℃, nóng chảy không phân hủy tới 853 ℃, còn cao hơn nhiệt độ này thì bắt đầu phân hủy. Na2CO3 dễ tan trong nước, khi tan trong nước phát ra nhiều nhiệt do tạo thành hydrat.
8. Bài tập vận dụng liên quan
Câu 1. Khi nhiệt phân hoàn toàn NaHCO3 thì sản phẩm của phản ứng nhiệt phân là:
A. Na2CO3, CO2, H2O.
B. Na2O, CO2, H2O.
C. NaOH, CO2, H2O
D. NaOH, CO2, H2.
Câu 2. Nhiệt phân hoàn toàn 16,8 gam NaHCO3, thu được m gam Na2CO3. Giá trị của m là
A. 21,2.
B. 12,4.
C. 13,2.
D. 10,6.
2NaHCO3 Na2CO3 + H2O + CO2
Theo PTHH: nNa2CO3 = 0,5.nNaHCO3 = 0,5(16,8/84) = 0,1 mol
=> m = mNa2CO3 = 0,1.106 = 10,6 gam
Câu 3. Trường hợp không xảy ra phản ứng với NaHCO3 khi
A. tác dụng với CO2
B. tác dụng với axit
C. đun nóng
D. tác dụng với kiềm
NaHCO3 tác dụng với kiềm: NaHCO3 + NaOH → Na2CO3 + H2O.
Đun nóng NaHCO3: 2NaHCO3 → Na2CO3 + CO2 + H2O
NaHCO3 tác dụng với axit: NaHCO3 + HCl → NaCl + CO2 + H2O
Câu 4. Chất nào sau đây khi cho vào nước không làm thay đổi pH?
A. NH4Cl.
B. KCl.
C. Na2CO3.
D. HCl.
Câu 5. Nhỏ từ từ từng giọt đến hết 30 ml dung dịch HCl 1M vào 100 ml dung dịch chứa Na2CO3 0,2M và NaHCO3 0,2M, sau phản ứng thu được số mol CO2 là
A. 0,020.
B. 0,030.
C. 0,015.
D. 0,010.
nHCl = 0,03 (mol)
nNa2CO3 = 0,1.0,2 = 0,02 (mol);
nNaHCO3 = 0,1.0,2 = 0,02 (mol)
Khi nhỏ từ từ H+ vào dd hỗn hợp CO32- và HCO3- xảy ra phản ứng:
H+ + CO32- → HCO3- (1)
H+ + HCO3- → CO2 + H2O (2)
=> nCO2 (2) = ∑nH+ - nCO32- = 0,03 – 0,02 = 0,01 (mol)
Câu 6. Thực hiện thí nghiệm sau: cho mảnh đồng kim loại vào dung dịch HNO3 loãng. Sau phản ứng có hiện tượng gì xảy ra:
A. Không có hiện tượng gì
B. dung dịch có màu xanh, H2 bay ra
C. dung dịch có màu xanh, có khí màu nâu bay ra
D. dung dịch có màu xanh, có khí không màu bay ra, bị hoá nâu trong không khí.
Đáp án D
Câu 7. Phản ứng nhiệt phân muối nitrat nào sau đây sai:
A. NH4NO3 N2O + 2H2O
B. 2NaNO3 2NaNO2 + O2
C. 2AgNO3 2Ag + 2NO2 + O2
D. 2Fe(NO3)2 2FeO + 4NO2 + O2
Đáp án D:
4Fe(NO3)3 → 2Fe2O3 + 12NO2 + 3O2
Câu 8. Nung 33,6g hỗn hợp Fe(NO3)3, Cu(NO3)2 sau phản ứng thu được 2,24 lit khí oxi (đktc). Chất rắn sau khi nung có khối lượng là:
A. 12 g
B. 24 g
C. 34 g
D. 46 g
mkhí= 0,4.46 + 0,1.32 = 21,6 gam
⇒ mchất rắn = 33,6 – 21,6 = 12 gam)
Câu 9. Cho từ từ 100 ml dung dịch hỗn hợp gồm Na2CO3 0,2M và KHCO3 0,1M vào 100 ml dung dịch HCl 0,2M, khuấy đều phản ứng hoàn toàn thu được V ml khí CO2 (đktc). Giá trị của V là
A. 448,0
B. 268,8
C. 191,2
D. 336,0
Đáp án B
Vì cho từ từ muối vào axit lúc đầu axit rất dư nên các chất phản ứng theo tỷ lệ mol
nNa2CO3: nNaHCO3 = 0,2 : 0,1 = 2 : 1 = 2x : x
CO32- + 2H+ → CO2 + H2O
HCO3- + H+ →CO2 + H2O
Từ phương trình ta có: nHCl= 2.nCO32-+ nHCO3- = 4x + x = 0,02 => x = 0,004 mol
=> nCO2= nCO32- + nHCO3- = 2x + x = 0,012 mol => V = 0,2688 lít = 268,8 ml
Xem thêm các chương trình khác:
- Các dạng bài tập Tiếng Anh thông dụng nhất
- 3000 câu hỏi ôn tập môn Tiếng Anh có đáp án
- Toàn bộ kiến thức về cụm động từ | Định nghĩa và cách dùng
- 500 đoạn văn Tiếng Anh thông dụng nhất và cách làm
- 1000 câu hỏi ôn tập môn Công nghệ có đáp án
- 1000 câu hỏi ôn tập Giáo dục công dân
- 15000 câu hỏi ôn tập môn Toán có đáp án
- Wiki Toán | Khái niệm, định lí, tính chất, dạng bài, công thức
- Tuyển tập đề thi + chuyên đề ôn thi Toán Kangaroo các cấp độ (có đáp án 2024)
- 3000 câu hỏi ôn tập môn Vật lí có đáp án
- Tổng hợp Dạng bài - Công thức môn Vật lí
- 2000 câu hỏi ôn tập môn Tin học có đáp án
- 3000 câu hỏi ôn tập môn Lịch sử có đáp án
- 3000 câu hỏi ôn tập môn Địa lí có đáp án
- 2000 câu hỏi ôn tập môn Sinh học có đáp án
- Tổng hợp Dạng bài - Công thức môn Sinh học
- Tổng hợp về các tác giả văn học
- 3000 câu hỏi ôn tập môn Ngữ văn có đáp án
- Tổng hợp kiến thức Ngữ Văn
- Trò chơi Powerpoint | Game Powerpoint
- Tổng hợp bài thu hoạch BDTX Giáo viên mầm non (2024) theo Thông tư 12
- Tổng hợp bài thu hoạch BDTX Giáo viên tiểu học (2024)
- Tổng hợp bài thu hoạch BDTX Giáo viên THCS (2024)
- Tổng hợp bài thu hoạch BDTX Giáo viên THPT (2024)
