Fe + HCl → FeCl2 + H2 | Fe ra FeCl2
Fe + HCl → FeCl2 + H2 là phản ứng oxi hóa khử. Bài viết này cung cấp đầy đủ thông tin về phương trình hóa học đã được cân bằng, điều kiện các chất tham gia phản ứng, hiện tượng (nếu có), ... Mời các bạn đón xem:
Phản ứng Fe + HCl → FeCl2 + H2
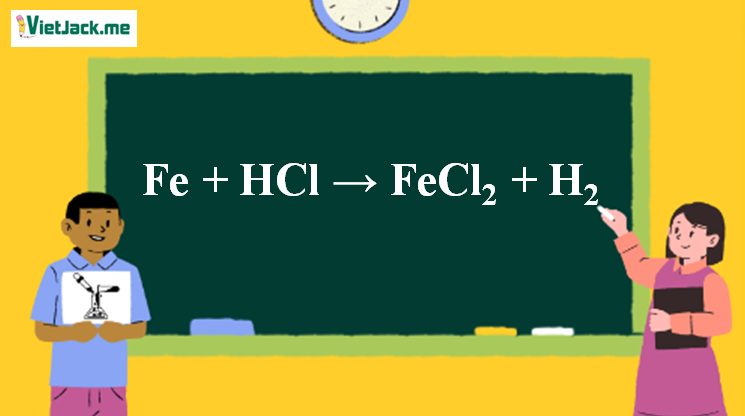
1. Phương trình Fe ra FeCl2
Fe + HCl → FeCl2 + H2
2. Điều kiện phản ứng Sắt tác dụng với axit clohidric
Nhiệt độ thường
3. Cách thực hiện phản ứng Fe tác dụng với HCl
Cho một ít kim loại Fe vào đáy ống nghiệm, nhỏ 1 - 2 ml dung dịch axit HCl vào ống nghiệm đã bỏ sẵn mẩu Fe.
4. Hiện tượng sau phản ứng Fe tác dụng với HCl
Kim loại bị tan dần, đồng thời có bọt khí không màu thoát ra.
Axit clohicđric là axit mạnh, có khả năng tác dụng với kim loại đứng trước hidro. Và khi cho Fe tác dụng với axit HCl chỉ cho muối sắt (II).
5. Bản chất của các chất tham gia phản ứng
5.1. Bản chất của Fe (Sắt)
- Trong phản ứng trên Fe là chất khử.
- Fe là kim loại có tính khử trung bình tác dụng được với các axit. (Chú ý: Fe bị thụ động hoá trong HNO3 đặc nguội, H2SO4 đặc nguội)
5.2. Bản chất của HCl (Axit clohidric)
- Trong phản ứng trên HCl là chất oxi hoá.
- HCl tác dụng với kim loại đứng trước H trong dãy hoạt động hóa học (trừ Pb) tạo thành muối và khí H2.
6. Thông tin mở rộng về Fe
6.1. Tính chất vật lí của Sắt
Màu trắng hơi xám, dẻo, dễ rèn, dễ dát mỏng, kéo sợi; dẫn nhiệt và dẫn điện kém đồng và nhôm.
Sắt có tính nhiễm từ nhưng ở nhiệt độ cao (800oC) sắt mất từ tính. tonc = 1540oC.
Sắt là kim loại nặng, khối lượng riêng D = 7,86g/cm3.
6.2. Trạng thái tự nhiên của Sắt
Là kim loại phổ biến sau nhôm, tồn tại chủ yếu ở các dạng:
+ Hợp chất: oxit, sunfua, silicat…
+ Quặng: hematit đỏ (Fe2O3 khan), hematit nâu (Fe2O3.nH2O), manhetit (Fe3O4), xiđerit (FeCO3) và pirit (FeS2).
6.3. Tính chất hóa học của sắt
-
Tác dụng với phi kim
Với oxi: 3Fe + 2O2 Fe3O4
Với clo: 2Fe + 3Cl2 2FeCl3
Với lưu huỳnh: Fe + S FeS
Ở nhiệt độ cao, sắt phản ứng được với nhiều phi kim.
-
Tác dụng với dung dịch axit
Tác dụng với với HCl, H2SO4 loãng
Fe + 2HCl → FeCl2 + H2
Tác dụng với H2SO4 đặc, nóng; HNO3 đặc:
2Fe + 6H2SO4 → Fe2(SO4)3 + 3SO2 + 6H2O
Không tác dụng với H2SO4 đặc nguội, HNO3 đặc, nguội
-
Tác dụng với dung dịch muối
Đẩy được kim loại yếu hơn ra khỏi muối
Fe + CuSO4 → FeSO4 + Cu
6.4. Ứng dụng của Fe
- Sắt có trong những đồ dùng cá nhân như: dao, kềm, kéo, kệ sắt, các loại dụng cụ gia đình khác,…
- Sắt ở trong các đồ nội thất như: bàn ghế, khung cửa, tủ kệ, cầu thang,…
- Các loại máy móc trong gia đình như máy xay, máy giặt, bồn rửa cũng có sắt.
- Trong giao thông vận tải sắt cũng đóng vai trò rất quan trọng.
- Sắt là bộ khung sườn cho những công trình xây dựng như nhà cửa, cầu, tòa nhà,…
7. Tính chất hoá học của HCl
Dung dịch axit HCl có đầy đủ tính chất hoá học của một axit mạnh.
7.1. Tác dụng chất chỉ thị
Dung dịch HCl làm quì tím hoá đỏ (nhận biết axit)
HCl → H+ + Cl-
7.2. Tác dụng với kim loại
Tác dụng với KL (đứng trước H trong dãy Bêkêtôp) tạo muối (với hóa trị thấp của kim loại) và giải phóng khí hidrô (thể hiện tính oxi hóa)
Fe + 2HCl 
2Al + 6HCl 
Cu + HCl → không có phản ứng
7.3. Tác dụng với oxit bazo và bazo
Sản phẩm tạo muối và nước
NaOH + HCl → NaCl + H2 O
CuO + 2HCl 
Fe2 O3 + 6HCl
7.4. Tác dụng với muối (theo điều kiện phản ứng trao đổi)
CaCO3 + 2HCl → CaCl2 + H2O + CO2↑
AgNO3 + HCl → AgCl↓ + HNO3
(dùng để nhận biết gốc clorua )
Ngoài tính chất đặc trưng là axit , dung dịch axit HCl đặc còn thể hiện vai trò chất khử khi tác dụng chất oxi hoá mạnh như KMnO4, MnO2, K2 Cr2O7, MnO2, KClO3 ……
4HCl + MnO2 
K2 Cr2 O7 + 14HCl → 3Cl2 + 2KCl + 2CrCl3 + 7H2 O
Hỗn hợp 3 thể tích HCl và 1 thể tích HNO3 đặc được gọi là hỗn hợp nước cường toan ( cường thuỷ) có khả năng hoà tan được Au ( vàng)
3HCl + HNO3 → 2Cl + NOCl + 2H2O
NOCl → NO + Cl
Au + 3Cl → AuCl3
8. Bài tập vận dụng liên quan
Câu 1. Kim loại Fe không phản ứng được với
A. Dung dịch HCl
B. Dung dịch H2SO4 loãng
C. Dung dịch CuCl2
D. H2SO4 đặc, nguội
Lời giải:
Câu 2. Để nhận biết sự có mặt của Fe trong hỗn hợp gồm Fe và Ag có thể dùng dung dịch nào
A. HCl
B. AgNO3
C. H2SO4 đặc, nguội
D. NaOH
Lời giải:
Câu 3. Phát biểu nào sau đây sai?
A. NaCl được dung làm muối ăn và bảo quản thực phẩm.
B. HCl tác dụng với sắt tạo ra muối sắt (III)
C. Axit HCl vừa có tính oxi hóa, vừa có tính khử.
D. Nhỏ dung dịch AgNO3 vào dung dịch HCl, có kết tủa trắng.
Lời giải:
A. Đúng
B. Sai
HCl tan nhiều trong nước
C. Đúng
D. Đúng
Tạo kết tủa AgCl
AgNO3 + HCl→ AgCl↓(kết tủa trắng) + HNO3
Câu 4. Kim loại tác dụng với dung dịch HCl và tác dụng với khí Cl2 đều thu được cùng một muối là
A. Fe
B. Zn
C. Cu
D. Ag
Lời giải:
Kim loại tác dụng với HCl và với Cl2 cho cùng 1 loại muối clorua là Zn.
Loại A vì Fe cho 2 loại muối (FeCl2, FeCl3)
Loại B và D vì không phản ứng với HCl
Câu 5. Trong phòng thí nghiệm có thể điều chế khí hidro clorua bằng cách
A. Cho NaCl tinh thể tác dụng với H2SO4 đặc, đun nóng.
B. Cho NaCl tinh thể tác dụng với HNO3 đặc, đun nóng.
C. Cho NaCl tinh thể tác dụng với H2SO4 loãng, đun nóng.
D. Cho NaCl tinh thể tác dụng với HNO3 loãng, đun nóng.
Lời giải:
Trong phòng thí nghiệm có thể điều chế khí hiđro clorua bằng cách: cho NaCl tinh thể tác dụng với H2SO4 đặc, đun nóng.
NaCl rắn + H2SO4 đặc → NaHSO4 + HCl
Câu 6. Cho 8,4 gam một kim loại hóa trị II phản ứng hết với dung dịch HCl dư, thu được 3,36 lít H2 (đktc). Kim loại đó là
A. Ca
B. Ba
C. Fe
D. Mg
Lời giải:
nH2 = 0,15 mol
Bảo toàn electron
2nM = 2nH2 ⇒ nM = nH2 = 0,15 mol
⇒ M =8,40,15 = 56 (Fe)
Câu 7. Cho 8,85 gam hỗn hợp X gồm Al, Mg tác dụng với dung dịch HCl dư, thu được 8,96 lít H2 (đktc). Thành phần phần trăm khối lượng của Al trong X là
A. 69,23%
B. 54,24%
C. 45,76%
D. 51,92%
Lời giải:
nH2 = 0,3 mol
Bảo toàn electron
3nAl + 2nMg = 2nH2 ⇒ 3nAl + 2nMg = 0,85 (1)
mhh = 27nAl + 24nMg = 8,85 (2)
Giải hệ (1) và (2) ⇒ nAl = 0,15 (mol); nMg = 0,2 mol
⇒ %mAl = 0,15.278,85.100% = 45,76%
Câu 8. Sắt tác dụng với H2O ở nhiệt độ cao hơn 570oC thì tạo ra H2 và sản phẩm rắn là
A. FeO.
B. Fe3O4.
C. Fe2O3.
D. Fe(OH)2.
Lời giải:
Câu 9. Hòa tan 10 gam hỗn hợp bột Fe và Fe2O3 bằng một lượng dung dịch HCl vừa đủ, thu được 1,12 lít hidro (đktc) và dd X. Cho dd X tác dụng với dd NaOH lấy dư. Lấy kết tủa thu được đem nung nóng trong không khí đến khối lượng không đổi thu được chất rắn Y. Khối lượng chất rắn Y là:
A. 16 gam.
B. 11,6 gam.
C. 12 gam.
D. 15 gam.
Lời giải:
nH2(đktc) = 1,1222,4= 0,05 (mol)
Phương trình hóa học:
Fe + 2HCl → FeCl2 + H2↑ (1)
Fe2O3 + 6HCl → 2FeCl3 + 3H2O (2)
Theo phương trình hóa học (1): nFe = nH2 = 0,05 (mol) → mFe = 0,05×56 = 2,8 (g)
→ mFe2O3 = mhh - mFe = 10 - 2,8 =7,2 (g) → nFe2O3 = 7,2160 = 0,045 (mol)
Theo phương trình hóa học (1): nFeCl2 = nFe = 0,05 (mol)
Theo phương trình hóa học (2): nFeCl3 = 2nFe2O3 = 2.0,05 = 0,1 (mol)
dung dịch X thu được chứa: FeCl2: 0,05 (mol) và FeCl3: 0,1 (mol)
FeCl2 + 2NaOH → Fe(OH)2 + NaCl
FeCl3 + 3NaOH → Fe(OH)3 + NaCl
Kết tủa thu được Fe(OH)2 và Fe(OH)3
Nung 2 kết tủa này thu được Fe2O3
BTNT "Fe": 2nFe2O3 = nFeCl2 + nFeCl3 → nFe2O3 = 0,05+0,12 = 0,075 (mol)
→ mFe2O3 = 0,075 × 160 = 12 (g)
Câu 10. Có 4 kim loại X, Y, Z, T đứng sau Mg trong dãy hoạt động hoá học. Biết rằng:
X và Y tác dụng với dung dịch HCl giải phóng khí hidro.
Z và T không phản ứng với dung dịch HCl.
Y tác dụng với dung dịch muối của X và giải phóng X.
T tác dụng được với dung dịch muối của Z và giải phóng Z.
Hãy xác định thứ tự sắp xếp nào sau đây là đúng (theo chiều hoạt động hóa học giảm dần)
A. Y, T, Z, X
B. T, X, Y, Z
C. Y, X, T, Z
D. X, Y, Z, T
Lời giải:
X, Y phản ứng được với HCl => X, Y đứng trước H trong dãy hoạt động hóa học
Z, T không phản ứng với HCl => Z, T đứng sau H trong dãy hoạt động hóa học
=> X, Y có tính khử mạnh hơn Z, T. Giờ chỉ so sánh Z và T
T đẩy được Z ra khỏi muối của Z => T có tính khử mạnh hơn Z
=> Z là có tính khử yếu nhất
Câu 11. Khi điều chế FeCl2 bằng cách cho Fe tác dụng với dung dịch HCl. Để bảo quản dung dịch FeCl2 thu được không bị chuyển thành hợp chất sắt (III), người ta có thể cho thêm vào dung dịch
A. một lượng sắt dư .
B. một lượng kẽm dư.
C. một lượng HCl dư.
D. một lượng HNO3 dư.
Lời giải:
Dung dịch FeCl2 dễ bị không khí oxi hóa thành muối Fe3+. Để bảo quản FeCl2 người ta thêm 1 lương Fe vì: Fe + 2Fe3+ → 3Fe2+
Không dùng HNO3 vì HNO3 oxi hóa luôn ion Fe2+ thành Fe3+,
Không dùng Zn sẽ tạo ra 1 lượng muối Zn2+,
Không dùng HCl sẽ không ngăn cản quá trình tạo Fe3+.
Câu 12. Khử m gam Fe3O4 bằng khí H2 thu được hổn hợp X gồm Fe và FeO, hỗn hợp X tác dụng vừa hết với 1,5 lít dung dịch H2SO4 0,2M (loãng). Giá trị của m là
A. 46,4 gam.
B. 23,2 gam.
C. 11,6 gam.
D. 34,8 gam.
Lời giải:
Theo bài ra, xác định được sau phản ứng chỉ thu được FeSO4
→ nFeSO4 = nSO42- = naxit = 0,3 mol.
Bảo toàn nguyên tố Fe → nFe3O4 = 0,33 = 0,1 mol
→ m = 0,1.232 = 23,2 gam.
Câu 13. Tính chất vật lí nào dưới đây không phải là tính chất của Fe kim loại?
A. Kim loại nặng, khó nóng chảy.
B. Màu vàng nâu, cứng và giòn.
C. Dẫn điện và nhiệt tốt.
D. Có tính nhiễm từ.
Lời giải:
Sắt là kim loại nặng
Có màu trắng, dẻo, dễ rèn → Đáp án B sai.
Có khối lượng lớn 7,9g/cm3, nóng chảy ở nhiệt độ 1540oC → kim loại nặng, khó nóng chảy.
Có tính dẫn điện, dẫn nhiệt tốt.
Có tính nhiễm từ.
Câu 14. Sục khí Clo vào lượng dung dịch NaOH ở nhiệt độ thường sản phẩm là
A. NaCl, NaClO2
B. NaCl, NaClO3
C. NaCl, NaClO
D. chỉ có NaCl
Lời giải:
Phương trình hóa học xảy ra:
Cl2 + 2NaOH → NaCl + NaClO + H2O
Vậy sản phẩm thu được có NaCl, NaClO.
Câu 15. Chỉ sử dụng một hóa chất duy nhất, nhận biết 4 dung dịch mất nhãn sau: KNO3, Cu(NO3)2, AgNO3, Fe(NO3)3. Dung dịch đó là:
A. dung dịch NaOH
B. dung dịch NaCl
C. dung dịch HCl
D. đung dịch H2SO4
Lời giải:
Đáp án: A
Trích mẫu thử và đánh số thứ tự
Sử dụng dung dịch NaOH để nhận biết
Mẫu thử nào xuất hiện kết tủa xanh, chất ban đầu là Cu(NO3)2
NaOH + Cu(NO3)2 → NaNO3 + Cu(OH)2
Mẫu thử nào xuất hiện kết tủa đỏ nâu thì chất ban đầu là Fe(NO3)3
Fe(NO3)3+ 3NaOH → Fe(OH)3 + 3NaNO3
Mẫu thử nào xuất hiện kết tủa trắng sau đó hóa đen, thì chất ban đầu là AgNO3
AgNO3 + NaOH → AgOH + NaNO3
AgOH → Ag2O + H2O
Dung dịch không có hiện tượng gì là KNO3
Xem thêm các phương trình hóa học khác:
Xem thêm các chương trình khác:
- Các dạng bài tập Tiếng Anh thông dụng nhất
- 3000 câu hỏi ôn tập môn Tiếng Anh có đáp án
- Toàn bộ kiến thức về cụm động từ | Định nghĩa và cách dùng
- 500 đoạn văn Tiếng Anh thông dụng nhất và cách làm
- 1000 câu hỏi ôn tập môn Công nghệ có đáp án
- 1000 câu hỏi ôn tập Giáo dục công dân
- 15000 câu hỏi ôn tập môn Toán có đáp án
- Wiki Toán | Khái niệm, định lí, tính chất, dạng bài, công thức
- Tuyển tập đề thi + chuyên đề ôn thi Toán Kangaroo các cấp độ (có đáp án 2024)
- 3000 câu hỏi ôn tập môn Vật lí có đáp án
- Tổng hợp Dạng bài - Công thức môn Vật lí
- 2000 câu hỏi ôn tập môn Tin học có đáp án
- 3000 câu hỏi ôn tập môn Lịch sử có đáp án
- 3000 câu hỏi ôn tập môn Địa lí có đáp án
- 2000 câu hỏi ôn tập môn Sinh học có đáp án
- Tổng hợp Dạng bài - Công thức môn Sinh học
- Tổng hợp về các tác giả văn học
- 3000 câu hỏi ôn tập môn Ngữ văn có đáp án
- Tổng hợp kiến thức Ngữ Văn
- Tuyển tập truyện dân gian, truyền thuyết, cổ tích,... Việt Nam
- Tổng hợp các đề đọc - hiểu có đáp án chi tiết
- Trò chơi Powerpoint | Game Powerpoint
- Tổng hợp bài thu hoạch BDTX Giáo viên mầm non (2025) theo Thông tư 12
- Tổng hợp bài thu hoạch BDTX Giáo viên tiểu học (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THCS (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THPT (2025)
