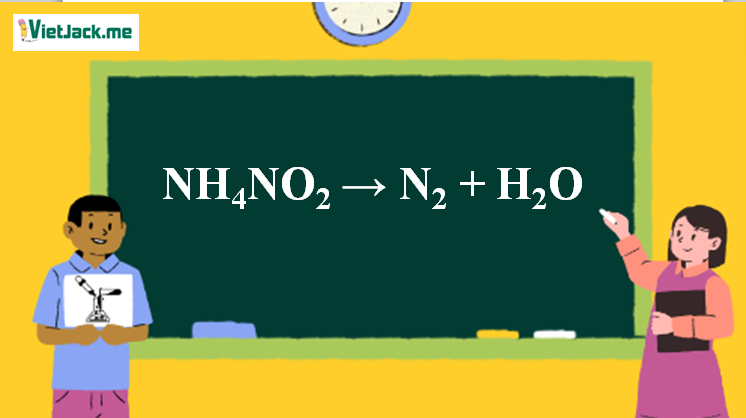
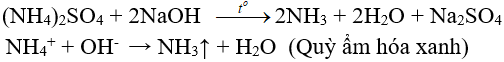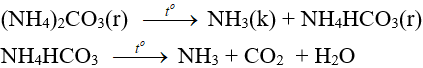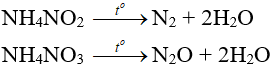NH4NO2 → N2 + H2O | NH4NO2 ra N2
NH4NO2 → N2 + H2O là phản ứng phân hủy. Bài viết này cung cấp đầy đủ thông tin về phương trình hóa học đã được cân bằng, điều kiện các chất tham gia phản ứng, hiện tượng (nếu có), ... Mời các bạn đón xem:
Phản ứng NH4NO2 → N2 + H2O
1. Phương trình điều chế N2 trong phòng thí nghiệm
NH4NO2 N2 + 2H2O
2. Điều kiện điều chế N2 trong phòng thí nghiệm
Nhiệt độ
3. Bản chất của NH4NO2 (Amoni nitrit) trong phản ứng
NH4NO2 là muối amoni nên bị phân huỷ bởi nhiệt một cách dễ dàng.
4. Điều chế nito tinh khiết trong phòng thí nghiệm
Đun nóng nhẹ dung dịch bão hòa muối amoni nitrit.
5. Phương pháp điều chế nito
Điều chế N2 trong phòng thí nghiệm ra sao
Điều chế N2 trong phòng thí nghiệm người ta sử dụng phương pháp đun nóng dung dịch bão hòa muối amoni nitrit
NH4NO2 → N2 + 2H2O
Hoặc trong phòng thí nghiệm có thể điều chế N2 bằng cách thu khí Nitơ sau phản ứng dưới đây xảy ra.
Sau đây là phương trình điều chế N2 trong phòng thí nghiệm
NH4Cl + NaCl → N2 + NaCl + 2H2O
Phương pháp điều chế N2 trong công nghiệp
Trong công nghiệp người ta thường điều chế N2 từ không khí. Để điều chế nito trong công nghiệp, người ta sử dụng phương pháp chưng cất phân đoạn không khí lỏng.
Đầu tiên, cần loại bỏ hơi nước H2O ra khỏi không khí.
Bước tiếp theo trong phương pháp điều chế N2 trong công nghiệp là loại bỏ khí CO2. Hợp chất sau khi thu được sau khi loại bỏ hơi nước và CO2 sẽ được hóa lỏng dưới áp suất cao và nhiệt độ thấp.
Sau đó lại tăng dần nhiệt độ của khối khí đã hóa lỏng ở nhiệt độ thấp lên đến -196 độ C thì lúc này xảy ra hiện tượng khí nitơ bị sôi và tách hẳn ra khỏi oxi.
Sau cùng qua các bước sẽ thu được khí N2 – nito tinh khiết
6. Tính chất hoá học của muối amoni
6.1.Phản ứng thuỷ phân
Tạo môi trường có tính axit làm quỳ tím hoá đỏ.
NH4+ + HOH → NH3 + H3O+ (Tính axit)
6.2. Tác dụng với dung dịch kiềm
(nhận biết ion amoni, điều chế amoniac trong phòng thí nghiệm)
6.3. Phản ứng nhiệt phân
- Muối amoni chứa gốc của axit không có tính oxi hóa khi nung nóng bị phân hủy thành NH3.
NH4HCO3 (bột nở) được dùng làm xốp bánh.
- Muối amoni chứa gốc của axit có tính oxi hóa khi bị nhiệt phân cho ra N2, N2O.
- Nhiệt độ lên tới 500oC, ta có phản ứng:
2NH4NO3 → 2N2 + O2 + 4H2O
7. Ứng dụng của muối amoni
Amoni là nguồn nito quan trọng đối với nhiều loài thực vật đặc biệt là đối với những loài mọc trên đất nhiều oxy. Tuy nhiên nó cũng đọc đối với hầu hết các loại cây trồng và hhiếmkhi được sử dụng làm nguôn nito duy nhất. Nito liên kết với protein trong sinh khối chết, được vi sinh vật tiêu thụ chuyển đổi thành các ion amoni ( NH4 + ) có thể được hấp thụ trực tiếp bởi rễ của cây.
Thông qua NH4 + thực vật thủy sinh có thể hấp thụ và kết hợp nito vào protein, axit amin và các phân tử khác. Nồng độ amoni cao có thể làm tăng sự phát triển của tảo và thực vật thủy sinh.
Các muối amoni được sử dụng rộng rãi trong chế biến thực phẩm.
8. Bài tập vận dụng liên quan
Câu 1. Trong phòng thí nghiệm nitơ được điều chế từ
A. NH4NO2.
B. NH3.
C. không khí
D. NH4NO3.
Lời giải:
Trong phòng thí nghiệm, người ta điều chế khí N2 từ NH4NO2
NH4NO2 N2 + 2H2O
Câu 2. Điều chế N2 tinh khiết trong phòng thí nghiệm bằng cách
A. nhiệt phân NaNO2
B. Đun hỗn hợp NaCl và NH4Cl
C. Đun nóng nhẹ dung dịch bão hòa muối amoni nitrit
D. phân hủy khí NH3
Lời giải:
Trong phòng thí nghiệm có thể điều chế N2 bằng cách thu khí Nitơ sau phản ứng dưới đây xảy ra. Sau đây là phương trình điều chế N2 trong phòng thí nghiệm
NH4Cl + NaCl → N2 + NaCl + 2H2O
Câu 3. Nhiệt phân hoàn toàn KNO3 thu được lần lượt các sản phẩm là
A. KNO2, NO2, O2.
B. KNO2, O2.
C. KNO2, NO2.
D. K2O, NO2, O2.
Lời giải:
2KNO3 ⟶ 2KNO2 + O2↑
=> Nhiệt phân KNO3 sản phẩm thu được là KNO2 và O2
Câu 4. Dung dịch NH3 có thể hòa tan được Zn(OH)2 là do:
A. Zn(OH)2 là một bazo ít tan
B. Zn(OH)2 có khả năng tạo thành phức chất tan
C. Zn(OH)2 là một bazo lưỡng tính
D. NH3 là một hợp chất có cực và là một bazo yếu
Lời giải:
Câu 5. Hỗn hợp X gồm NH4Cl và (NH4)2SO4. Cho X tác dụng với dung dịch Ba(OH)2 dư, đun nhẹ thu được 18,6 gam kết tủa và 4,48 lít khí thoát ra. Hỗn hợp X có khối lượng là:
A. 10,56
B. 12,7
C. 5,35
D. 6,35
Lời giải:
Gọi x, y lần lượt là số mol NH4Cl; (NH4)2SO4 lần lượt là
Phản ứng xảy ra:
2NH4Cl + Ba(OH)2→ BaCl2 + 2NH3 + 2H2O
x → x
(NH4)2SO4 + Ba(OH)2 → BaSO4 + 2NH3+ 2H2O
y → y →2y
nBaSO4 = 18,64233 = 0,08 mol
nBaSO4 = n(NH4)2SO4 = y = 0,08 mol
nNH3 = 4,4822,4 = 0,2 mol
Theo phương trình nNH3 = x + 2y = 0,2 mol => x = 0,04 mol
mX= mNH4Cl + m(NH4)2SO4 = 53,5x + 132y = 12,7 gam
Xem thêm các phương trình hóa học khác:
NH4NO3 + Ba(OH)2 → Ba(NO3)2 + NH3 + H2O
NH4NO3 + NaOH → NaNO3 + NH3 + H2O
Xem thêm các chương trình khác:
- Các dạng bài tập Tiếng Anh thông dụng nhất
- 3000 câu hỏi ôn tập môn Tiếng Anh có đáp án
- Toàn bộ kiến thức về cụm động từ | Định nghĩa và cách dùng
- 500 đoạn văn Tiếng Anh thông dụng nhất và cách làm
- 1000 câu hỏi ôn tập môn Công nghệ có đáp án
- 1000 câu hỏi ôn tập Giáo dục công dân
- 15000 câu hỏi ôn tập môn Toán có đáp án
- Wiki Toán | Khái niệm, định lí, tính chất, dạng bài, công thức
- Tuyển tập đề thi + chuyên đề ôn thi Toán Kangaroo các cấp độ (có đáp án 2024)
- 3000 câu hỏi ôn tập môn Vật lí có đáp án
- Tổng hợp Dạng bài - Công thức môn Vật lí
- 2000 câu hỏi ôn tập môn Tin học có đáp án
- 3000 câu hỏi ôn tập môn Lịch sử có đáp án
- 3000 câu hỏi ôn tập môn Địa lí có đáp án
- 2000 câu hỏi ôn tập môn Sinh học có đáp án
- Tổng hợp Dạng bài - Công thức môn Sinh học
- Tổng hợp về các tác giả văn học
- 3000 câu hỏi ôn tập môn Ngữ văn có đáp án
- Tổng hợp kiến thức Ngữ Văn
- Tuyển tập truyện dân gian, truyền thuyết, cổ tích,... Việt Nam
- Tổng hợp các đề đọc - hiểu có đáp án chi tiết
- Trò chơi Powerpoint | Game Powerpoint
- Tổng hợp bài thu hoạch BDTX Giáo viên mầm non (2025) theo Thông tư 12
- Tổng hợp bài thu hoạch BDTX Giáo viên tiểu học (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THCS (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THPT (2025)