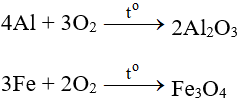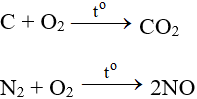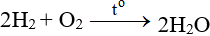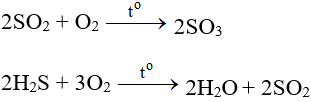SO2 + O2 + H2O → H2SO4 l SO2 ra H2SO4
SO2 + O2 + H2O → H2SO4 là phản ứng hóa hợp. Bài viết này cung cấp đầy đủ thông tin về phương trình hóa học đã được cân bằng, điều kiện các chất tham gia phản ứng, hiện tượng (nếu có), ... Mời các bạn đón xem:
Phản ứng SO2 + O2 + H2O → H2SO4
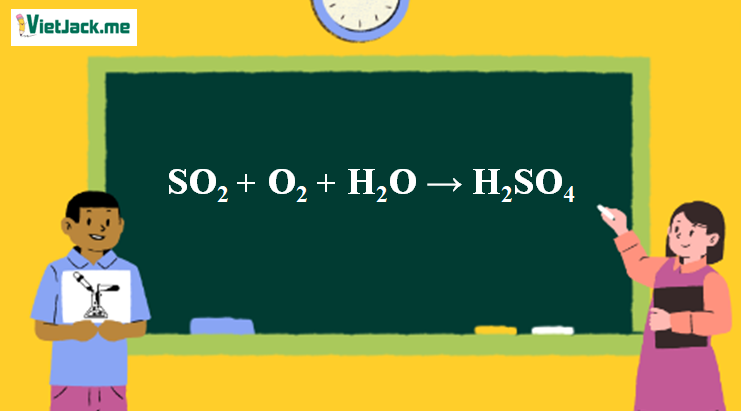
1. Phương trình hóa học SO2 ra H2SO4
2SO2 + O2 + 2H2O → 2H2SO4
2. Sản xuất H2SO4 trong công nghiệp
Axít sulfuric được sản xuất từ lưu huỳnh, oxi và nước theo công nghệ tiếp xúc.
Trong giai đoạn đầu lưu huỳnh bị đốt để tạo ra đioxít lưu huỳnh.
(1) S(r) + O2(k) SO2(k)
Sau đó nó bị ôxi hóa thành triôxít lưu huỳnh bởi oxi với sự có mặt của V2O5 ở nhiệt độ 450oC)
(2) 2SO2 + O2(k) 2SO3(k)
Cuối cùng triôxít lưu huỳnh được xử lý bằng nước (trong dạng 97-98% H2SO4 chứa 2-3% nước) để sản xuất axít sulfuric 98-99%.
(3) SO3(k) + H2O(l) → H2SO4(l)
3. Tính chất hóa học của SO2
3.1. Lưu huỳnh đioxit tác dụng với nước
SO2 + H2O ⇋ H2SO3
3.2. Lưu huỳnh đioxit tác dụng với dung dịch bazơ
(có thể tạo thành 2 loại muối sunfit và hiđrosunfit)
SO2 + NaOH → NaHSO3
SO2 + 2NaOH → Na2SO3 + H2O
3.3. Lưu huỳnh đioxit tác dụng với oxit bazơ → muối
SO2 + CaO → CaSO3
3.4. SO2 vừa là chất khử, vừa là chất oxi hóa
(do S trong SO2 có mức oxi hóa trung gian +4)
3.5. Lưu huỳnh đioxit là chất oxi hóa
SO2 + 2H2S → 3S + 2H2O
Lưu huỳnh đioxit là chất khử
4. Ứng dụng của S02
- Trong phòng thí nghiệm, SO2 được điều chế bằng cách cho muối sunfit tác dụng với axit mạnh như HCl, H2SO4.
Ví dụ: Na2SO3 + 2 HCl → 2 NaCl + H2O + SO2
- Ngoài ra, khí SO2 còn được điều chế bằng cách cho Cu tác dụng với H2SO4 đặc.
Cu + 2H2SO2 đặc → CuSO4 + SO2 + 2H2O
Khí SO2 được thu bằng phương pháp đẩy không khí.
5. Tính chất hóa học của O2
- Khi tham gia phản ứng, nguyên tử O dễ dàng nhận thêm 2e. Nguyên tử oxi có độ âm điện lớn (3,44), chỉ kém flo (3,98).
- Do vậy, oxi là nguyên tố phi kim hoạt động hoá học, có tính oxi hoá mạnh. Trong các hợp chất (trừ hợp chất với flo), nguyên tố oxi có số oxi hoá là -2.
- Oxi tác dụng với hầu hết các kim loại (trừ Au, Pt, ...) và các phi kim (trừ halogen). Oxi tác dụng với nhiều hợp chất vô cơ và hữu cơ.
5.1. Tác dụng với kim loại
Tác dụng với hầu hết kim loại (trừ Au và Pt), cần có to tạo oxit:
5.2. Tác dụng với phi kim
Tác dụng với hầu hết phi kim (trừ halogen), cần có to tạo oxit:
ĐB: Tác dụng với H2 nổ mạnh theo tỉ lệ 2:1 về số mol:
5.3. Tác dụng với hợp chất
- Tác dụng với các chất có tính khử:
- Tác dụng với các chất hữu cơ:
6. Bài tập
Câu 1. Nhận xét nào sau đây không đúng về H2SO4?
A. H2SO4 tan tốt trong nước
B. H2SO4 loãng có đầy đủ tính chất chung của axit.
C. H2SO4 có tính axit mạnh, tác dụng với tất cả các kim loại
D. H2SO4 đặc có tính háo nước.
Lời giải:
Đáp án: C
Câu 2. Cho các phát biểu sau:
(a) Axit sunfuric là chất lỏng, sánh như dầu, không màu, không bay hơi,
(b) Axit sunfuric tan vô hạn trong nước, và tỏa rất nhiều nhiệt,
(c) Khi pha loãng axit sunfuric đặc, ta cho nhanh nước vào axit và khuấy nhẹ
(d) Axit sunfuric đặc có tính háo nước, khi tiếp xúc với H2SO4 đặc dễ gây bỏng nặng..
(e) H2SO4 loãng có đầy đủ tính chất chung của axit.
Số phát biểu đúng là:
A. 4
B. 2
C. 3
D. 5
Lời giải:
Đáp án: A
Giải thích:
Phát biểu đúng là (a), (b), (d) (e) (có 4 phát biểu đúng)
Phát biểu (c) sai vì khi pha loãng axit sunfuric đặc, ta cho từ từ axit vào nước và khuấy nhẹ.
Câu 3. Các khí nào sau đây đều làm mất màu dung dịch brom?
A. SO2, H2S, N2
B. SO2, H2S
C. SO2, CO2, H2S
D. SO2, CO2
Lời giải:
Đáp án: B
Giải thích:
SO2 + Br2 + H2O → HBr + H2SO4
H2S + 4Br2 + 4H2O → H2SO4 + 8HBr
Câu 4. Kim loại nào sau đây không tác dụng với dung dịch H2SO4loãng?
A. Al
B. Mg
C. Na
D. Cu
Lời giải:
Đáp án: D
Giải thích:
2Al + 3H2SO4loãng → Al2(SO4)3 + 3H2
Mg + H2SO4 loãng → MgSO4 + H2
2Na + 2H2SO4 → Na2SO4 + SO2 + 2H2O
Câu 5. Dãy kim loại nào trong các dãy sau đây gồm các kim loại đều không tác dụng với dung dịch H2SO4 loãng?
A. Al, Mg, Cu
B. Fe, Mg, Ag
C. Al, Fe, Mg
D. Al, Fe, Cu
Lời giải:
Đáp án: C
Giải thích:
2Al + 3H2SO4loãng → Al2(SO4)3 + 3H2
Mg + H2SO4 loãng → MgSO4 + H2
Fe + H2SO4 loãng → FeSO4 + H2
Câu 6. Dãy kim loại nào trong các dãy sau đây gồm các kim loại đều không tác dụng với dung dịch H2SO4 đặc, nguội?
A. Al, Fe, Au, Mg
B. Zn, Pt, Au, Mg
C. Al, Fe, Zn, Mg
D. Al, Fe, Au, Pt
Lời giải:
Đáp án: D
Câu 7. Cho phương trình hóa học:
aAl + bH2SO4 → cAl2(SO4)3 + dSO2 + eH2O
Tỉ lệ a:b là
A.1:1
B. 2:3
C. 1:3
D. 1:2
Lời giải:
Đáp án: B
Giải thích:
2Al + 6H2SO4 → Al2(SO4)3 + 3SO2 + 6H2O
Câu 8. Phương trình hóa học nào sau đây không đúng?
A. Cu + 2H2SO4(đặc) → CuSO4 + SO2 + 2H2O
B. Fe + S FeS
C. 2Ag + O3 Ag2O + O2
D. 2Fe + 3H2SO4(loãng) → Fe2(SO4)3+ 3H2
Lời giải:
Đáp án: D
Câu 9. Nguyên tố lưu huỳnh có số hiệu nguyên tử là 16. Vị trí của lưu huỳnh trong bảng tuần hoàn các nguyên tố hóa học là
A. chu kì 3, nhóm VIA.
B. chu kì 5, nhóm VIA.
C. chu kì 3, nhóm IVA.
D. chu kì 5, nhóm IVA.
Lời giải:
Đáp án: A
Giải thích:
Cấu hình electron nguyên tử S là: 1s22s22p63s23p4.
→ Lưu huỳnh ở chu kỳ 3 (do có 3 lớp electron); nhóm VIA (do có 6 electron hóa trị, nguyên tố p).
Câu 10. Cho các phản ứng hóa học sau:
S + O2 SO2
S + 3F2 SF6
S + Hg → HgS
S + 6HNO3 (đặc) H2SO4 + 6NO2 + 2H2O
Trong các phản ứng trên, số phản ứng trong đó S thể hiện tính khử là
A. 3
B. 2
C. 4
D. 1
Lời giải:
Đáp án: C
Câu 11. Hơi thủy ngân rất dộc, bởi vậy khi làm vỡ nhiệt kế thủy ngân thì chất bột được dùng để rắc lên thủy ngân rồi gom lại là
A. vôi sống.
B. cát.
C. muối ăn.
D. lưu huỳnh.
Lời giải:
Đáp án: D
Câu 12. Nguyên tử S đóng vai trò vừa là chất khử, vừa là chất oxi hóa trong phản ứng nào sau đây?
A. 4S + 6NaOH (đặc) 2Na2S + Na2S2O3 +3H2O
B. S + 3F2 SF6
C. S + 6HNO3 (đặc) H2SO4 + 6NO2 + 2H2O
D. S + 2Na Na2S
Lời giải:
Đáp án: A
Câu 13. Đun nóng 4,8 gam bột Mg với 9,6 gam bột lưu huỳnh (trong điều kiện không có không khí), thu được chất rắn X. Cho toàn bộ X vào lượng dư dung dịch HCl, thu được V lít khí (đktc). Giá trị của V là
A. 2,24
B. 3,36
C. 4,48
D. 6,72
Lời giải:
Đáp án: C
Giải thích:
Mg + S → MgS
nMg = 0,2 (mol); nS =0,3 (mol) => S dư; nMgS= 0,2 (mol)
MgS + 2HCl → MgCl2 + H2S ↑
=> V = 0,2.22,4 = 4,48 (lít)
Câu 14. Dãy các chất tác dụng được với dung dịch H2SO4 loãng tạo thành sản phẩm có chất khí là
A. K2SO3, BaCO3, Zn.
B. Al, ZnO, KOH.
C. CaO, Fe, BaCO3.
D. Zn, Fe2O3, Na2SO3.
Lời giải:
Đáp án: A
Giải thích:
A.
K2SO3 + H2SO4→ K2SO4 + SO2 + H2O
BaCO3 + H2SO4 → BaSO4 + CO2 + H2O
Zn + H2SO4 → ZnSO4 + H2
B.
2Al + 3H2SO4 → Al2(SO4)3 + 3H2↑
H2SO4 + ZnO → H2O + ZnSO4
H2SO4 + 2NaOH → 2H2O + Na2SO4
→ Loại vì có 2 phản ứng với MgO và KOH không sinh ra khí
C.
CaO + H2SO4 → H2O + CaSO4
Fe + H2SO4 → H2 + FeSO4
BaCO3 + H2SO4 → H2O + CO2 + BaSO4
→ Loại vì có 2 phản ứng với BaO không sinh ra khí
D.
H2SO4 + Zn → H2 + ZnSO4
Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2O
Na2SO3 + H2SO4→ Na2SO4 + SO2 + H2O
→ Loại vì có phản ứng với Fe2O3 không sinh ra khí
Câu 15. Dung dịch A tác dụng với CuO tạo ra dung dịch có màu xanh lam. A là
A. KOH
B. Na2CO3
C. H2SO4
D. Ca(OH)2
Lời giải:
Đáp án: C
Giải thích:
CuO là oxit bazơ => tan trong dung dịch axit H2SO4 tạo muối CuSO4có màu xanh lam
CuO + H2SO4 → CuSO4 + H2O
Xem thêm các phương trình phản ứng hóa học khác:
Xem thêm các chương trình khác:
- Các dạng bài tập Tiếng Anh thông dụng nhất
- 3000 câu hỏi ôn tập môn Tiếng Anh có đáp án
- Toàn bộ kiến thức về cụm động từ | Định nghĩa và cách dùng
- 500 đoạn văn Tiếng Anh thông dụng nhất và cách làm
- 1000 câu hỏi ôn tập môn Công nghệ có đáp án
- 1000 câu hỏi ôn tập Giáo dục công dân
- 15000 câu hỏi ôn tập môn Toán có đáp án
- Wiki Toán | Khái niệm, định lí, tính chất, dạng bài, công thức
- Tuyển tập đề thi + chuyên đề ôn thi Toán Kangaroo các cấp độ (có đáp án 2025)
- 3000 câu hỏi ôn tập môn Vật lí có đáp án
- Tổng hợp Dạng bài - Công thức môn Vật lí
- 2000 câu hỏi ôn tập môn Tin học có đáp án
- 3000 câu hỏi ôn tập môn Lịch sử có đáp án
- 3000 câu hỏi ôn tập môn Địa lí có đáp án
- 2000 câu hỏi ôn tập môn Sinh học có đáp án
- Tổng hợp Dạng bài - Công thức môn Sinh học
- Tổng hợp về các tác giả văn học
- 3000 câu hỏi ôn tập môn Ngữ văn có đáp án
- Tổng hợp kiến thức Ngữ Văn
- Tuyển tập truyện dân gian, truyền thuyết, cổ tích,... Việt Nam
- Tổng hợp các đề đọc - hiểu có đáp án chi tiết
- Trò chơi Powerpoint | Game Powerpoint
- Tổng hợp bài thu hoạch BDTX Giáo viên mầm non (2025) theo Thông tư 12
- Tổng hợp bài thu hoạch BDTX Giáo viên tiểu học (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THCS (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THPT (2025)
- Tổng hợp thông tin, kiến thức chung
- Tiền tiểu học