NaAlO2 + HCl + H2O → Al(OH)3 + NaCl | NaAlO2 ra NaCl
NaAlO2 + HCl + H2O → Al(OH)3 + NaCl là phản ứng trao đổi. Bài viết này cung cấp đầy đủ thông tin về phương trình hóa học đã được cân bằng, điều kiện các chất tham gia phản ứng, hiện tượng (nếu có), ... Mời các bạn đón xem:
Phản ứng NaAlO2 + HCl + H2O → Al(OH)3 + NaCl
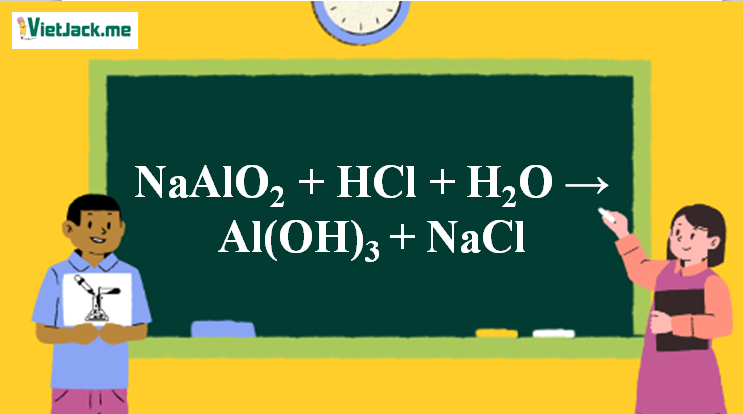
1. Phương trình hóa học NaAlO2 + HCl
NaAlO2 + HCl + H2O → Al(OH)3 + NaCl
2. Điều kiện phản ứng xảy ra NaAlO2 + HCl
Nhiệt độ thường
3. Cách thực hiện phản ứng NaAlO2 + HCl
Cho từ từ vừa đủ dung dịch axit HCl vào dung dịch muối NaAlO2 tạo kết tủa keo trắng Al(OH)3 và dung dịch muối NaCl.
Nếu dư dung dịch HCl vào dung dịch NaAlO2 kết tủa bị hoà tan dần cho đến hết.
3HCl + Al(OH)3 → AlCl3 + 3H2O
4. Tính chất hoá học của NaAlO2
4.1. Tính chất vật lí & nhận biết
- Tính chất vật lí: Là chất rắn, màu trắng, không mùi, tan tốt trong nước cho dung dịch không màu.
- Nhận biết: Sục CO2 vào dung dịch, thấy xuất hiện kết tủa keo trắng
2H2O + NaAlO2 + CO2 → Al(OH)3↓ + NaHCO3
4.2. Tính chất hóa học
- Tác dụng với axit:
2H2O + NaAlO2 + CO2 → Al(OH)3↓ + NaHCO3
H2O + HCl + NaAlO2 → Al(OH)3↓ + NaCl
4.3. Điều chế
- Điều chế bằng cách cho nhôm phản ứng với dung dịch NaOH.
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
4.4. Ứng dụng
- Trong việc xử lý nước nó được dùng như là chất thêm vào trong hệ thống làm mềm nước, như là chất đông tụ để cải thiện sự kết tụ, và để loại bỏ silica và các hợp chất phosphat hoà tan.
- Trong công nghệ xây dựng, natri aluminat được dùng để tăng nhanh tốc độ hoá rắn của bê tông, chủ yếu khi làm việc trong điều kiện lạnh giá.
- Natri aluminat còn được dùng trong công nghiệp giấy, sản xuất gạch chịu lửa, sản xuất alumina v. v..
- Dung dịch natri aluminat là trung gian trong sản xuất các zeolit.
5. Tính chất hoá học của HCl
Dung dịch axit HCl có đầy đủ tính chất hoá học của một axit mạnh.
5.1. Tác dụng chất chỉ thị
Dung dịch HCl làm quì tím hoá đỏ (nhận biết axit)
HCl → H+ + Cl-
5.2. Tác dụng với kim loại
Tác dụng với KL (đứng trước H trong dãy Bêkêtôp) tạo muối (với hóa trị thấp của kim loại) và giải phóng khí hidrô (thể hiện tính oxi hóa)
Fe + 2HCl 
2Al + 6HCl 
Cu + HCl → không có phản ứng
5.3. Tác dụng với oxit bazo và bazo
Sản phẩm tạo muối và nước
NaOH + HCl → NaCl + H2 O
CuO + 2HCl 
Fe2 O3 + 6HCl
5.4. Tác dụng với muối (theo điều kiện phản ứng trao đổi)
CaCO3 + 2HCl → CaCl2 + H2O + CO2↑
AgNO3 + HCl → AgCl↓ + HNO3
(dùng để nhận biết gốc clorua )
Ngoài tính chất đặc trưng là axit , dung dịch axit HCl đặc còn thể hiện vai trò chất khử khi tác dụng chất oxi hoá mạnh như KMnO4, MnO2, K2 Cr2O7, MnO2, KClO3 ……
4HCl + MnO2 
K2 Cr2 O7 + 14HCl → 3Cl2 + 2KCl + 2CrCl3 + 7H2 O
Hỗn hợp 3 thể tích HCl và 1 thể tích HNO3 đặc được gọi là hỗn hợp nước cường toan ( cường thuỷ) có khả năng hoà tan được Au ( vàng)
3HCl + HNO3 → 2Cl + NOCl + 2H2O
NOCl → NO + Cl
Au + 3Cl → AuCl3
6. Bài tập vận dụng liên quan
Câu 1. Cho dần dần đến dư dung dịch HCl vào dung dịch NaAlO2,sau phản ứng hiện tượng quan sát được là:
A. Có kết tủa trắng keo xuất hiện, kết tủa không tan.
B. Không có hiện tượng gì
C. Có kết tủa trắng keo xuất hiện
D. Có kết tủa trắng keo xuất hiện, sau đó kết tủa tan hết.
Lời giải:
Câu 2. Kim loại tác dụng với dung dịch HCl và tác dụng với khí Cl2 đều thu được cùng một muối là
A. Fe
B. Zn
C. Cu
D. Ag
Lời giải:
Câu 3. Công dụng nào sau đây không phải của NaCl?
A. Làm thức ăn cho người và gia súc, gia cầm
B. Làm dịch truyền trong ngành y tế
C. Điều chế Cl2, HCl, nước Javen
D. Khử chua cho đất trồng
Lời giải:
Câu 4. Để điều chế HCl trong phòng thí nghiệm, người ta sử dụng phương pháp:
A. Phương pháp sunfat
B. Phương pháp tổng hợp
C. Clo hóa các hợp chất hữu cơ
D. Phương pháp khác
Lời giải:
Xem thêm các chương trình khác:
- Các dạng bài tập Tiếng Anh thông dụng nhất
- 3000 câu hỏi ôn tập môn Tiếng Anh có đáp án
- Toàn bộ kiến thức về cụm động từ | Định nghĩa và cách dùng
- 500 đoạn văn Tiếng Anh thông dụng nhất và cách làm
- 1000 câu hỏi ôn tập môn Công nghệ có đáp án
- 1000 câu hỏi ôn tập Giáo dục công dân
- 15000 câu hỏi ôn tập môn Toán có đáp án
- Wiki Toán | Khái niệm, định lí, tính chất, dạng bài, công thức
- Tuyển tập đề thi + chuyên đề ôn thi Toán Kangaroo các cấp độ (có đáp án 2024)
- 3000 câu hỏi ôn tập môn Vật lí có đáp án
- Tổng hợp Dạng bài - Công thức môn Vật lí
- 2000 câu hỏi ôn tập môn Tin học có đáp án
- 3000 câu hỏi ôn tập môn Lịch sử có đáp án
- 3000 câu hỏi ôn tập môn Địa lí có đáp án
- 2000 câu hỏi ôn tập môn Sinh học có đáp án
- Tổng hợp Dạng bài - Công thức môn Sinh học
- Tổng hợp về các tác giả văn học
- 3000 câu hỏi ôn tập môn Ngữ văn có đáp án
- Tổng hợp kiến thức Ngữ Văn
- Trò chơi Powerpoint | Game Powerpoint
- Tổng hợp bài thu hoạch BDTX Giáo viên mầm non (2024) theo Thông tư 12
- Tổng hợp bài thu hoạch BDTX Giáo viên tiểu học (2024)
- Tổng hợp bài thu hoạch BDTX Giáo viên THCS (2024)
- Tổng hợp bài thu hoạch BDTX Giáo viên THPT (2024)
