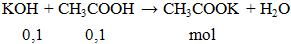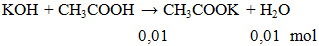KOH + CH3COOH → CH3COOK + H2O l KOH ra CH3COOK
KOH + CH3COOH → CH3COOK + H2O là phản ứng trao đổi. Bài viết này cung cấp đầy đủ thông tin về phương trình hóa học đã được cân bằng, điều kiện các chất tham gia phản ứng, hiện tượng (nếu có), ... Mời các bạn đón xem:
Phản ứng KOH + CH3COOH → CH3COOK + H2O
1. Phản ứng hóa học
KOH + CH3COOH → CH3COOK + H2O
2. Điều kiện phản ứng
Phản ứng xảy ra ngay điều kiện thường.
3. Cách thực hiện phản ứng
Nhỏ từ từ KOH vào ống nghiệm chứa CH3COOH và một mẩu quỳ tím.
4. Hiện tượng nhận biết phản ứng
Ban đầu mẩu quỳ có màu đỏ, sau khi nhỏ KOH mẩu quỳ mất màu đỏ, dư KOH mẩu quỳ chuyển sang màu xanh.
5. Bản chất của các chất tham gia phản ứng
5.1. Bản chất của KOH (Kali hidroxit)
KOH là một bazo mạnh tác dụng được với các axit hữu cơ để tạo thành muối và thủy phân este, peptit.
5.2. Bản chất của CH3COOH (Axit axetic) trong phản ứng
- CH3COOH là axit cacboxylic dễ dàng tham gia các phản ứng thế hoặc trao đổi nguyên tử H hoặc nhóm -OH của nhóm chức -COOH.
- CH3COOH mang tính axit nên tác dụng với bazơ, oxit bazơ tạo thành muối và nước.
6. Tính chất hoá học của KOH
KOH là một bazo mạnh có khả năng làm thay đổi màu sắc các chất chỉ thị như khiến quỳ tím chuyển sang màu xanh, còn dung dịch phenolphtalein không màu thành màu hồng.
6.1. Tác dụng với oxit axit
Ở điều kiện nhiệt độ phòng, KOH tác dụng với SO2, CO2,...
KOH + SO2 → K2SO3 + H2O
KOH + SO2 → KHSO3
6.2. Tác dụng với axit
-
Tác dụng với axit tạo thành muối và nước
KOH(dd) + HCl(dd) → KCl(dd) + H2O
-
Tác dụng với các axit hữu cơ để tạo thành muối và thủy phân este, peptit
RCOOR1 + KOH → RCOOK + R1OH
6.3. Tác dụng với kim loại
KOH tác dụng với kim loại mạnh tạo thành bazo mới và kim loại mới.
KOH + Na → NaOH + K
6.4. Tác dụng với muối
KOH tác dụng với muối để tạo thành muối mới và axit mới
2KOH + CuCl2 → 2KCl + Cu(OH)2↓
6.5. KOH điện li mạnh
KOH là một bazo mạnh, trong nước phân ly hoàn toàn thành ion K+ và OH-
6.6. KOH phản ứng với một số oxit kim loại mà oxit, hidroxit của chúng lưỡng tính
KOH phản ứng được với một số oxit kim loại mà oxit, hidroxit của chúng lưỡng tính như nhôm, kẽm,…
2KOH + 2Al + 2H2O → 2KAlO2 + 3H2↑
2KOH + Zn → K2ZnO2 + H2↑
6.7. Phản ứng với một số hợp chất lưỡng tính
KOH + Al(OH)3 → KAlO2 + 2H2O
2KOH + Al2O3 → 2KAlO2 + H2O
7. Tính chất vật lý của KOH
- Khối lượng riêng: 2.044 g/cm3
- Độ pH: 13
- Nhiệt độ sôi: 1.327oC (1.6000 K; 2.421 oF)
- Nhiệt độ nóng chảy: 406 oC (679 K; 763 oF)
- Độ hòa tan trong nước:7 g/ml (0 oC); 121 g/ml (25 oC); 178 g/ml (100 oC)
- Khả năng hòa tan chất khác: có thể được hòa tan trong alcohol, glycerol và không tan được trong ether.
8. Tính chất hoá học của axit axetic
- Nguyên tử hydro trong nhóm cacboxyl có thể cung cấp một proton H+, làm chúng có tính chất axit, tuy nhiên, axit axetic là một axit yếu thuộc nhóm axit monoprotic. Dung dịch có nồng độ mol 1 M (giấm ăn trong gia đình) có độ pH là 2.4, tức chỉ có 0.44 % phân tử axit axetic bị phân ly.
- Axit axetic lỏng là dung môi phân cực với hằng số điện ly khoảng 6.2.
- Nó có khả năng hòa tan các hợp chất không phân cực như dầu, các nguyên tố lưu huỳnh, iot và các dung môi phân cực như nước, chloroform, hexan.
- Axit axetic CH3COOH (etanoic) là một axit hữu cơ, mạnh hơn axit cacbonic. Nó được tào thành bằng việc liên kết nhóm methyl CH3 với cacboxyl COOH.
- Axit axetic tác dụng với bazo, cacbonat và bicacbonat để tạo ra axetat kim loại tương ứng, nước và cacbonic (phổ biến nhất là natri bicacbonat với giấm ăn):
NaHCO3 + CH3COOH → CH3COONa + CO2 + H2O
- Trừ crom (II) axetat, tất cả các axetat khác đều tan được trong nước.
- Tác dụng với kiềm tạo ra nước và ethanoat kim loại:
NaOH + CH3COOH → CH3COONa + H2O
- Axit axetic phân hủy ở nhiệt độ lớn hơn 440oC tạo thành cacbonic, metan hoặc ethenon và nước.
- Tác dụng với rượu tạo thành este:
ROH + CH3COOH → CH3COOR + H2O
- Axit axetic làm ăn mòn các kim loại và tạo ra khí hydro và các muối axetat:
Mg + 2CH3COOH → (CH3COO)2Mg + H2
- Nhôm thụ động với axit axetic do khi phản ứng, nó tạo ra lớp màng mỏng nhôm oxit trên bề mặt, ngăn chặn sự ăn mòn. Vì vậy, các nhà sản xuất vẫn thường dùng bình chứa bằng nhôm để đựng dung dịch này.
- Phản ứng thế halogen vào gốc hydrocacbon ( 90 - 100oC):
Cl2 + CH3COOH → ClCH2COOH + HCl
- Tác dụng với axetylen (xúc tác thủy ngân, nhiệt độ 70 - 80oC) thành etyl diaxetat:
C2H2 + 2CH3COOH → CH3CH(OCOCH3)2
- Tác dụng với amoniac tạo thành amid:
NH3 + CH3COOH → NH3CH3COOHNH4
- Phản ứng decacboxyl hóa thành axeton (Xúc tác mangan oxit, nhiệt độ):
C2H2+ CH3COOH → CH2CHOCOCH3
8. Câu hỏi vận dụng
Câu 1. Cho 0,1 mol KOH phản ứng vừa đủ với 100ml CH3COOH aM. Giá trị của a là
A. 0,1. B. 0,01. C. 0,05. D. 1.
Lời giải:
a = 0,1 : 0,1 = 1M.
Đáp án D.
Câu 2. Phản ứng nào sau đây là phản ứng trung hòa?
A. 2KOH + CO2 → K2CO3 + H2O
B. KOH + SO2 → KHSO3
C. KOH + CH3COOH → CH3COOK + H2O
D. 2KOH + CuSO4 → K2SO4 + Cu(OH)2
Lời giải:
Phản ứng trung hòa là phản ứng KOH + CH3COOH → CH3COOK + H2O
Đáp án C.
Câu 3. Cho 100ml CH3COOH 0,1M phản ứng vừa đủ với dung dịch KOH thu được dung dịch X. Khối lượng muối tan có trong dung dịch X là
A. 0,745g. B. 0,98g. C. 0,754g. D. 1,10g.
Lời giải:
mmuối = 0,01.98 = 0,98 gam.
Đáp án B.
Xem thêm các phương trình hóa học khác:
KOH + NH4NO3 → KNO3 + NH3 + H2O
KOH + (NH4)2SO4 → K2SO4 + NH3 + H2O
Xem thêm các chương trình khác:
- Các dạng bài tập Tiếng Anh thông dụng nhất
- 3000 câu hỏi ôn tập môn Tiếng Anh có đáp án
- Toàn bộ kiến thức về cụm động từ | Định nghĩa và cách dùng
- 500 đoạn văn Tiếng Anh thông dụng nhất và cách làm
- 1000 câu hỏi ôn tập môn Công nghệ có đáp án
- 1000 câu hỏi ôn tập Giáo dục công dân
- 15000 câu hỏi ôn tập môn Toán có đáp án
- Wiki Toán | Khái niệm, định lí, tính chất, dạng bài, công thức
- Tuyển tập đề thi + chuyên đề ôn thi Toán Kangaroo các cấp độ (có đáp án 2024)
- 3000 câu hỏi ôn tập môn Vật lí có đáp án
- Tổng hợp Dạng bài - Công thức môn Vật lí
- 2000 câu hỏi ôn tập môn Tin học có đáp án
- 3000 câu hỏi ôn tập môn Lịch sử có đáp án
- 3000 câu hỏi ôn tập môn Địa lí có đáp án
- 2000 câu hỏi ôn tập môn Sinh học có đáp án
- Tổng hợp Dạng bài - Công thức môn Sinh học
- Tổng hợp về các tác giả văn học
- 3000 câu hỏi ôn tập môn Ngữ văn có đáp án
- Tổng hợp kiến thức Ngữ Văn
- Trò chơi Powerpoint | Game Powerpoint
- Tổng hợp bài thu hoạch BDTX Giáo viên mầm non (2024) theo Thông tư 12
- Tổng hợp bài thu hoạch BDTX Giáo viên tiểu học (2024)
- Tổng hợp bài thu hoạch BDTX Giáo viên THCS (2024)
- Tổng hợp bài thu hoạch BDTX Giáo viên THPT (2024)