KClO3 → KCl + O2 | KClO3 ra KCl | KClO3 ra O2
KClO3 → KCl + O2 là phản ứng phân hủy. Bài viết này cung cấp đầy đủ thông tin về phương trình hóa học đã được cân bằng, điều kiện các chất tham gia phản ứng, hiện tượng (nếu có), ... Mời các bạn đón xem:
Phản ứng KClO3 → KCl + O2
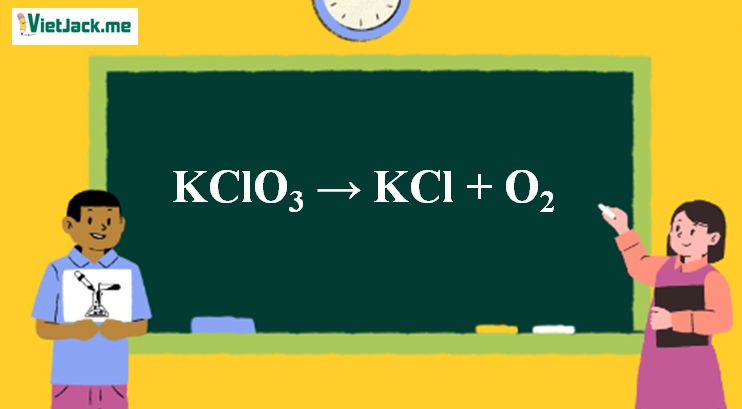
1. Phương trình nhiệt phân KClO3
2KClO3 2KCl + 3O2
2. Điều kiện phản ứng KClO3 ra KCl
Nhiệt độ
3. Bản chất của KClO3 (Kali clorat) trong phản ứng
Ở nhiệt độ 500℃ KClO3 bị phân hủy thành muối kali clorua và oxI. Phản ứng này hoàn toàn có thể xảy ra ở nhiệt độ thấp hơn nếu sử dụng MnO2 làm chất xúc tác.
4. Tính chất đặc trưng của KClO3
Muối Kali Clorat tồn tại ở thể rắn với các tính chất vật lý, hóa học điển hình mà không phải ai cũng hiểu. Hãy theo dõi cụ thể thông tin chia sẻ dưới đây để hiểu rõ hơn về loại muối cơ bản này nhé.
4.1. Tính chất vật lý
Kali Clorat công thức là Kali Clorat là gì? Tính chất lý hóa và ứng dụng của Kali Clorat, nhìn bằng mắt thường sẽ thấy đây là chất rắn màu trắng hoặc không có màu. Ngoài ra nó cũng có thể tồn tại ở dạng muối bột hay tinh thể kết tinh. Loại hóa chất này có vị mặn cơ bản và độc tính, khi uống từ 2 - 3 gram sẽ dẫn tới ngộ độc.
Về khả năng hòa tan trong nước, Kali Clorat khá ít tan trong nước lạnh, tuy nhiên nó lại tan nhiều trong nước nóng. Ngoài ra chúng còn có thể tan trong các hóa chất khác như Axeton, Glixerol,... Ở điều kiện nhiệt độ là 0oC, độ tan trong nước là 3,13g/ml, còn đối với nhiệt độ thường 25oC, độ tan là 8,15g/ml.
Khối lượng mol của hóa chất KClO3 là 122,5g/mol, khối lượng riêng là 2,32g/cm3. Điểm sôi của nó là 673K và điểm nóng chảy ở 629K, nhiệt dung riêng đo được của Kali Clorat là 100.25 J.mol.K
4.2. Tính chất hóa học
Như đã nói từ đầu, Kali Clorat là chất oxi hóa cực mạnh, có thể tác dụng với nhiều kim loại, phi kim loại để tạo ra muối và oxit tương ứng. Điển hình trong đó, chúng ta có thể lấy một số ví dụ về các phản ứng hóa học với Al, C, P, S, Mg,....
-
3C + KClO3→ 2KCl +3CO2
-
2Al + KClO3 → Al2O3 + KCl
-
6P + 5KClO3 → 5KCl + 3P2O5
-
3S + 2KClO3 → 2KCl + 3SO2
-
3Mg + KClO3 → KCl + 3MgO
Ngoài ra, KClO3 còn rất dễ bị phân hủy, nhất là khi bị nhiệt phân sẽ sinh ra lượng lớn khí oxi nên sử dụng nhiều trong điều chế oxi diện rộng.
-
4KClO3 → 3KClO4 + KCl
-
2KClO3 → 2KCl + 3O2
5. Bài tập vận dụng
Câu 1. Cho hỗn hợp khí ozon và oxi, sau một thời gian ozon bị phân hủy hết thì thể tích khí tăng lên so với ban đầu là 2 lít. Thể tích oxi và ozon trong hỗn hợp đầu lần lượt là:
A. 2 lít và 5 lít
B. 3 lít và 7 lít
C. 2 lít và 4 lít
D. 4 lít và 6 lít
Lời giải:
Đáp án: C
Câu 2. Nhận định nào sau đây về tính chất của oxi và ozon là đúng ?
A. Oxi tan trong nước nhiều hơn ozon
B. Không màu
C. Là chất khí ở điều kiện thường
D. Không mùi
Lời giải:
Đáp án: C
Câu 3. Khi nói về khả năng phản ứng của oxi, nhận xét sai là
A. Oxi phản ứng trực tiếp với hầu hết các kim loại.
B. Oxi phản ứng trực tiếp với tất cả các phi kim.
C. Oxi tham gia vào các quá trình xảy ra sự chất, sự gỉ, sự hô hấp.
D. Những phản ứng mà oxi tham gia đều là phản ứng oxi hóa – khử.
Lời giải:
Đáp án: B
Giải thích:
Nhận xét sai là: Oxi phản ứng trực tiếp với tất cả các phi kim.
Vì oxi không phản ứng trực tiếp với các halogen
Câu 4. Sự hình thành lớp ozon trên tầng bình lưu của khí quyển là do:
A. tia tử ngoại của mặt trời chuyển hoá các phân tử O2
B. Sự phóng điện (sét) trong khí quyển
C. Sự oxi hoá một số hợp chất hữu cơ trên mặt đất
D. cả A và B đều đúng
Lời giải:
Đáp án: D
Câu 5. Phản ứng tạo O3 từ O2 cần điều kiện :
A. tia lửa điện hoặc tia cực tím
B. Xúc tác Fe
C. Áp suất cao
D. Nhiệt độ cao
Lời giải:
Đáp án: A
Câu 6. Cặp chất nào sau đây không tác dụng được với nhau?
A. Ag và O3
B. CO và O2
C. Mg và O2
D. CO2 và O2
Lời giải:
Đáp án: D
Câu 7. Cho phản ứng hóa học sau:
2KMnO4 + 5H2O2 + 3H2SO4 → 2MnSO4 + 5O2 + K2SO4 + 8H2O
Trong phản ứng trên H2O2 đóng vai trò gì?
A. Chất oxi hóa
B. Chất khử
C. Vừa là chất oxi hóa vừa là chất khử
D. Chất môi trường
Lời giải:
Đáp án: B
Câu 8. Ở nhiệt độ thường
A. O2 không oxi hóa được Ag, O3 oxi hóa được Ag.
B. O2 oxi hóa được Ag, O3 không oxi hóa được Ag.
C. Cả O2 và O3 đều không oxi hóa được Ag.
D. Cả O2 và O3 đều oxi hóa được Ag.
Lời giải:
Đáp án: A
Xem thêm các phương trình phản ứng hóa học khác:
Xem thêm các chương trình khác:
- Các dạng bài tập Tiếng Anh thông dụng nhất
- 3000 câu hỏi ôn tập môn Tiếng Anh có đáp án
- Toàn bộ kiến thức về cụm động từ | Định nghĩa và cách dùng
- 500 đoạn văn Tiếng Anh thông dụng nhất và cách làm
- 1000 câu hỏi ôn tập môn Công nghệ có đáp án
- 1000 câu hỏi ôn tập Giáo dục công dân
- 15000 câu hỏi ôn tập môn Toán có đáp án
- Wiki Toán | Khái niệm, định lí, tính chất, dạng bài, công thức
- Tuyển tập đề thi + chuyên đề ôn thi Toán Kangaroo các cấp độ (có đáp án 2025)
- 3000 câu hỏi ôn tập môn Vật lí có đáp án
- Tổng hợp Dạng bài - Công thức môn Vật lí
- 2000 câu hỏi ôn tập môn Tin học có đáp án
- 3000 câu hỏi ôn tập môn Lịch sử có đáp án
- 3000 câu hỏi ôn tập môn Địa lí có đáp án
- 2000 câu hỏi ôn tập môn Sinh học có đáp án
- Tổng hợp Dạng bài - Công thức môn Sinh học
- Tổng hợp về các tác giả văn học
- 3000 câu hỏi ôn tập môn Ngữ văn có đáp án
- Tổng hợp kiến thức Ngữ Văn
- Tuyển tập truyện dân gian, truyền thuyết, cổ tích,... Việt Nam
- Tổng hợp các đề đọc - hiểu có đáp án chi tiết
- Trò chơi Powerpoint | Game Powerpoint
- Tổng hợp bài thu hoạch BDTX Giáo viên mầm non (2025) theo Thông tư 12
- Tổng hợp bài thu hoạch BDTX Giáo viên tiểu học (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THCS (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THPT (2025)
- Tổng hợp thông tin, kiến thức chung
- Tiền tiểu học
