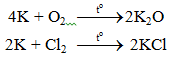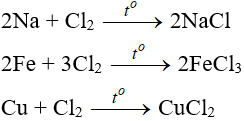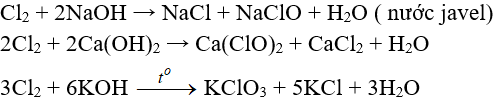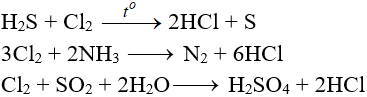K + Cl2 → KCl l K ra KCl
K + Cl2 → KCl là phản ứng oxi hóa khử. Bài viết này cung cấp đầy đủ thông tin về phương trình hóa học đã được cân bằng, điều kiện các chất tham gia phản ứng, hiện tượng (nếu có), ... Mời các bạn đón xem:
Phản ứng K + Cl2 → KCl
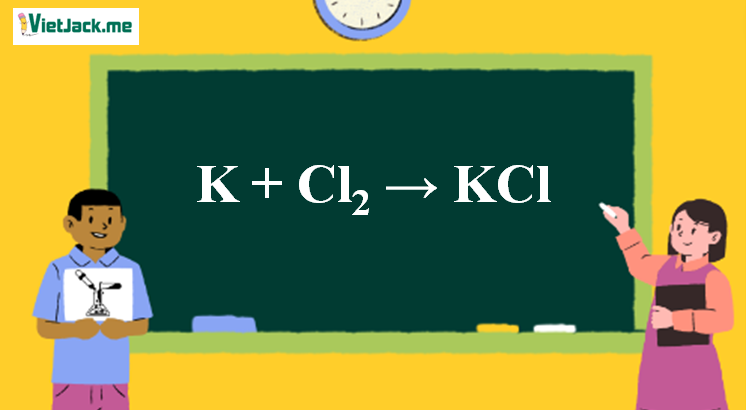
1. Phản ứng hóa học
2K + Cl2 → 2KCl
2. Điều kiện phản ứng
Nhiệt độ.
3. Cách thực hiện phản ứng
Cho kali tác dụng với khí clo thu được muối kaliclorua.
4. Hiện tượng nhận biết phản ứng
Kali nóng chảy cháy sáng trong khí clo tạo muối màu trắng.
5. Bản chất của các chất tham gia phản ứng
5.1. Bản chất của K (Kali)
- Trong phản ứng trên K là chất khử.
- K là kim loại kiềm có tính khử rất mạnh, K phản ứng với halogen toả nhiều nhiệt tạo thành muối.
5.2. Bản chất của Cl2 (Clo)
- Trong phản ứng trên Cl2 là chất oxi hoá.
- Cl2 có khả năng cho phản ứng với hầu hết các kim loại (trừ Au và Pt) ở điều kiện nhiệt độ để tạo thành các muối halogenua. (Muối thu được thường ứng với hóa trị cao nhất của kim loại tham gia phản ứng)
6. Tính chất hoá học của K
Kali là kim loại kiềm có tính khử rất mạnh.
K → K+ + 1e
6.1. Tác dụng với phi kim
6.2. Tác dụng với axit
2K + 2HCl → 2KCl + H2.
6.3. Tác dụng với nước
K tác dụng mãnh liệt với nước và tự bùng cháy tạo thành dung dịch kiềm và giải phóng khí hidro.
2K + 2H2O → 2KOH + H2.
6.4. Tác dụng với hidro
Kali tác dụng với hidro ở áp suất khá lớn và nhiệt độ khoảng 350 – 400oC tạo thành kali hidrua.
2K (lỏng) + H2 (khí) → 2KH (rắn)
7. Tính chất vật lí của Kali
- Kali là kim loại nhẹ thứ hai sau liti, là chất rắn rất mềm, dễ dàng cắt bằng dao và có màu trắng bạc.
- Kali bị ôxi hóa rất nhanh trong không khí và phải được bảo quản trong dầu mỏ hay dầu lửa.
- Có khối lượng riêng là 0,863 g/cm3; có nhiệt độ nóng chảy là 63,510C và sôi ở 7600C.
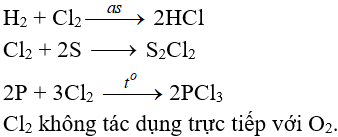
8. Tính chất hóa học của Cl2
8.1. Tác dụng với kim loại
Đa số kim loại và có to để khơi màu phản ứng tạo muối clorua (có hoá trị cao nhất)
8.2. Tác dụng với phi kim
(cần có nhiệt độ hoặc có ánh sáng)
8.3. Tác dụng với nước và dung dịch kiềm
Cl2 tham gia phản ứng với vai trò vừa là chất oxi hóa, vừa là chất khử.
Tác dụng với nuớc:
Khi hoà tan vào nước, một phần Clo tác dụng (Thuận nghịch)
Cl20 + H2O → HCl + HClO (Axit hipoclorơ)
Axit hipoclorơ có tính oxy hoá mạnh, nó phá hửy các màu vì thế nước clo hay clo ẩm có tính tẩy màu do.
Tác dụng với dung dịch bazơ:
8.4. Tác dụng với muối của các halogen khác
Cl2 + 2NaBr → 2NaCl + Br2
Cl2 + 2FeCl2 → 2FeCl3
3Cl2 + 6FeSO4 → 2Fe2(SO4)3 + 2FeCl3
Cl2 + 2KI → 2KCl + I2
8.5. Tác dụng với chất khử khác
8.6. Phản ứng thế, phản ứng cộng, phản ứng phân huỷ với một số hợp chất hữu cơ
9. Câu hỏi vận dụng
Câu 1. Cách bảo quản K đúng nhất :
A. Để ngoài không khí
B. Ngâm trong rượu
C. Ngâm trong dầu hỏa
D. Ngâm trong nước tinh khiết
Lời giải:
Đáp án C
Câu 2. Cho 1,95 g Na đun nóng trong khí clo thu được m g muối. Giá trị của m là:
A. 7,45 g B. 3,725 g
C. 14,9 g D. 1,49 g
Lời giải:
Đáp án B
Phương trình hóa học: 2K + Cl2 → 2KCl
NKCl = nK = 0,05 mol ⇒ mKCl = 0,05.74,5 = 3,725 g
Câu 3. Cho K tác dụng với Clo nung nóng. Hiện tượng phản ứng xảy ra là:
A. Kali nóng chảy cháy sáng trong khí clo
B. Kali phản ứng dịu nhẹ với khí clo
C. Kali phản ứng tỏa nhiều nhiệt khi tác dụng với khí clo đun nóng.
D. Kali tác dụng mãnh liệt với khí clo khi tiếp xúc.
Lời giải:
Đáp án A
Xem thêm các phương trình phản ứng hóa học khác:
Xem thêm các chương trình khác:
- Các dạng bài tập Tiếng Anh thông dụng nhất
- 3000 câu hỏi ôn tập môn Tiếng Anh có đáp án
- Toàn bộ kiến thức về cụm động từ | Định nghĩa và cách dùng
- 500 đoạn văn Tiếng Anh thông dụng nhất và cách làm
- 1000 câu hỏi ôn tập môn Công nghệ có đáp án
- 1000 câu hỏi ôn tập Giáo dục công dân
- 15000 câu hỏi ôn tập môn Toán có đáp án
- Wiki Toán | Khái niệm, định lí, tính chất, dạng bài, công thức
- Tuyển tập đề thi + chuyên đề ôn thi Toán Kangaroo các cấp độ (có đáp án 2024)
- 3000 câu hỏi ôn tập môn Vật lí có đáp án
- Tổng hợp Dạng bài - Công thức môn Vật lí
- 2000 câu hỏi ôn tập môn Tin học có đáp án
- 3000 câu hỏi ôn tập môn Lịch sử có đáp án
- 3000 câu hỏi ôn tập môn Địa lí có đáp án
- 2000 câu hỏi ôn tập môn Sinh học có đáp án
- Tổng hợp Dạng bài - Công thức môn Sinh học
- Tổng hợp về các tác giả văn học
- 3000 câu hỏi ôn tập môn Ngữ văn có đáp án
- Tổng hợp kiến thức Ngữ Văn
- Tuyển tập truyện dân gian, truyền thuyết, cổ tích,... Việt Nam
- Tổng hợp các đề đọc - hiểu có đáp án chi tiết
- Trò chơi Powerpoint | Game Powerpoint
- Tổng hợp bài thu hoạch BDTX Giáo viên mầm non (2025) theo Thông tư 12
- Tổng hợp bài thu hoạch BDTX Giáo viên tiểu học (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THCS (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THPT (2025)