CaO + HCl → CaCl2 + H2O | CaO ra CaCl2
CaO + HCl → CaCl2 + H2O là phản ứng trao đổi. Bài viết này cung cấp đầy đủ thông tin về phương trình hóa học đã được cân bằng, điều kiện các chất tham gia phản ứng, hiện tượng (nếu có), ... Mời các bạn đón xem:
Phản ứng CaO + HCl → CaCl2 + H2O
1. Phương trình phản ứng CaO ra CaCl2
CaO + 2HCl → CaCl2 + H2O
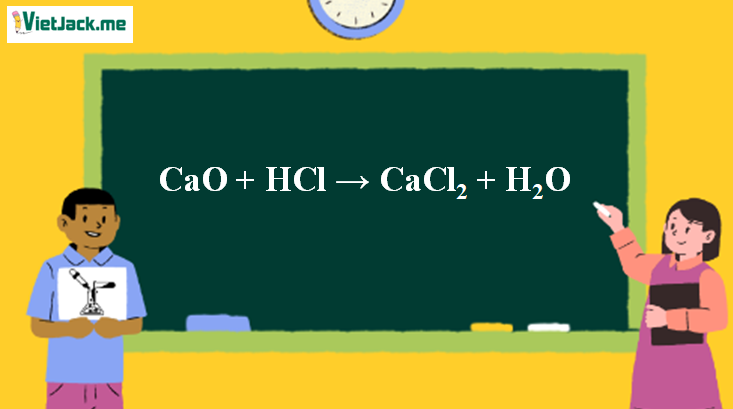
2. Điều kiện phản ứng CaO ra CaCl2
Nhiệt độ thường.
3. Bản chất của các chất tham gia phản ứng
3.1. Bản chất của CaO (Canxi oxit)
CaO mang đầy đủ tính chất của một oxit bazo tác dụng được với axit như HCl, HNO3, ...
3.2. Bản chất của HCl (Axit clohidric)
HCl là một axit mạnh tác dụng được với oxit bazo tạo muối và nước.
4. Mở rộng kiến thức về CaO
4.1. Tính chất vật lí & nhận biết
- Tính chất vật lí: CaO là chất rắn có dạng tinh thể màu trắng, là một chất ăn da và có tính kiềm.
- Nhận biết: Đem hòa tan bari oxit vào nước, tan tốt trong nước, tỏa nhiệt mạnh, sinh ra dung dịch hơi vẩn đục.
4.2. Tính chất hóa học
- Mang đầy đủ tính chất hóa học của oxit bazơ.
Tác dụng với nước:
CaO + H2O → Ca(OH)2
Tác dụng với axit:
CaO + 2HCl → CaCl2 + H2O
CaO + 2HNO3 → Ca(NO3)2 + H2O
Tác dụng với oxit axit:
CaO + CO2 → CaCO3
4.3. Điều chế
Canxi oxit thông thường được sản xuất bằng cách phân hủy bởi nhiệt (nung nóng) các loại vật liệu tự nhiên như đá vôi là khoáng chất chứa canxi cacbonat (CaCO3)
CaCO3 -to→ CaO + CO2
4.4. Ứng dụng
Công nghiệp thực phẩm: Vôi là một thành phần trong baking soda và giúp giữ trái cây và rau tươi.
Khai thác kim loại công nghiệp: Vôi còn được sử dụng vào khai thác kim lọai như đồng, thủy ngân, kẽm, niken, vàng,chì và bạc.
Sản xuất giấy: Các nhà sản xuất sử dụng vôi để phục hồi soda ăn da trong quá trình chuyển đổi của các mẩu gỗ để sản xuất bột giấy.
Kiểm soát ô nhiễm: vôi và đá vôi được sử dụng để hấp thụ lưu huỳnh đioxit từ khí thải trong smelters và các nhà máy phát điện.
Xử lý nước: bao gồm nước thải công nghiệp và nước sinh hoạt. Vôi trung hòa axit tạo ra chất thải trong ngành công nghiệp do đó cản trở sự ăn mòn và bảo vệ môi trường tự nhiên.. Vôi cũng loại bỏ silic, mangan, florua, sắt và các tạp chất khác trong nước. Nó làm mềm nước bằng cách loại bỏ độ cứng bicarbonate và tẩy uế chống lại vi khuẩn.
5. Tính chất hóa học của HCl
Dung dịch axit HCl có đầy đủ tính chất hoá học của một axit mạnh.
5.1. Tác dụng chất chỉ thị
Dung dịch HCl làm quì tím hoá đỏ (nhận biết axit)
HCl → H+ + Cl-
5.2. Tác dụng với kim loại
Tác dụng với KL (đứng trước H trong dãy Bêkêtôp) tạo muối (với hóa trị thấp của kim loại) và giải phóng khí hidrô (thể hiện tính oxi hóa)
Fe + 2HCl 
2Al + 6HCl 
Cu + HCl → không có phản ứng
5.3. Tác dụng với oxit bazo và bazo
Sản phẩm tạo muối và nước
NaOH + HCl → NaCl + H2 O
CuO + 2HCl 
Fe2 O3 + 6HCl
5.4. Tác dụng với muối (theo điều kiện phản ứng trao đổi)
CaCO3 + 2HCl → CaCl2 + H2O + CO2↑
AgNO3 + HCl → AgCl↓ + HNO3
(dùng để nhận biết gốc clorua )
Ngoài tính chất đặc trưng là axit , dung dịch axit HCl đặc còn thể hiện vai trò chất khử khi tác dụng chất oxi hoá mạnh như KMnO4, MnO2, K2 Cr2O7, MnO2, KClO3 ……
4HCl + MnO2 
K2 Cr2 O7 + 14HCl → 3Cl2 + 2KCl + 2CrCl3 + 7H2 O
Hỗn hợp 3 thể tích HCl và 1 thể tích HNO3 đặc được gọi là hỗn hợp nước cường toan ( cường thuỷ) có khả năng hoà tan được Au ( vàng)
3HCl + HNO3 → 2Cl + NOCl + 2H2O
NOCl → NO + Cl
Au + 3Cl → AuCl3
6. Bài tập vận dụng
Câu 1. Dãy chất tác dụng được với dung dịch HCl
A. Fe2O3, KMnO4, Cu.
B. Zn, CaO, Ba(OH)2.
C. BaCO3, H2SO4, Mg(OH)2.
D. AgNO3, MgCO3, BaSO4.
Lời giải:
Đáp án: B
Giải thích:
Dãy gồm các chất đều tác dụng với dung dịch HCl là Fe, CaO, Ba(OH)2.
Câu 2. Dãy oxit nào tác dụng được với nước?
A. K2O; Na2O; CuO; Fe2O3
B. K2O; CaO; N2O5; CO2
C. SO2; MgO; Fe2O3; Na2O
D. K2O; FeO; P2O5; SO2
Lời giải:
Đáp án: B
Giải thích:
K2O; CaO; N2O5; CO2
Câu 3. Oxít tác dụng với nước tạo ra dung dịch làm quỳ tím chuyển màu đỏ là:
A. CuO
B. CaO
C. K2O
D. SO3
Lời giải:
Đáp án: D
Câu 4. Oxit tác dụng với nước tạo ra dung dịch làm quỳ tím hóa xanh là:
A. CO2
B. P2O5
C. CaO
D. CuO
Lời giải:
Đáp án: C
Xem thêm các phương trình phản ứng hóa học khác:
Xem thêm các chương trình khác:
- Các dạng bài tập Tiếng Anh thông dụng nhất
- 3000 câu hỏi ôn tập môn Tiếng Anh có đáp án
- Toàn bộ kiến thức về cụm động từ | Định nghĩa và cách dùng
- 500 đoạn văn Tiếng Anh thông dụng nhất và cách làm
- 1000 câu hỏi ôn tập môn Công nghệ có đáp án
- 1000 câu hỏi ôn tập Giáo dục công dân
- 15000 câu hỏi ôn tập môn Toán có đáp án
- Wiki Toán | Khái niệm, định lí, tính chất, dạng bài, công thức
- Tuyển tập đề thi + chuyên đề ôn thi Toán Kangaroo các cấp độ (có đáp án 2025)
- 3000 câu hỏi ôn tập môn Vật lí có đáp án
- Tổng hợp Dạng bài - Công thức môn Vật lí
- 2000 câu hỏi ôn tập môn Tin học có đáp án
- 3000 câu hỏi ôn tập môn Lịch sử có đáp án
- 3000 câu hỏi ôn tập môn Địa lí có đáp án
- 2000 câu hỏi ôn tập môn Sinh học có đáp án
- Tổng hợp Dạng bài - Công thức môn Sinh học
- Tổng hợp về các tác giả văn học
- 3000 câu hỏi ôn tập môn Ngữ văn có đáp án
- Tổng hợp kiến thức Ngữ Văn
- Tuyển tập truyện dân gian, truyền thuyết, cổ tích,... Việt Nam
- Tổng hợp các đề đọc - hiểu có đáp án chi tiết
- Trò chơi Powerpoint | Game Powerpoint
- Tổng hợp bài thu hoạch BDTX Giáo viên mầm non (2025) theo Thông tư 12
- Tổng hợp bài thu hoạch BDTX Giáo viên tiểu học (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THCS (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THPT (2025)
- Tổng hợp thông tin, kiến thức chung
- Tiền tiểu học
