SO3 + H2O → H2SO4 | SO3 ra H2SO4
SO3 + H2O → H2SO4 là phản ứng hóa hợp. Bài viết này cung cấp đầy đủ thông tin về phương trình hóa học đã được cân bằng, điều kiện các chất tham gia phản ứng, hiện tượng (nếu có), ... Mời các bạn đón xem:
Phản ứng SO3 + H2O → H2SO4
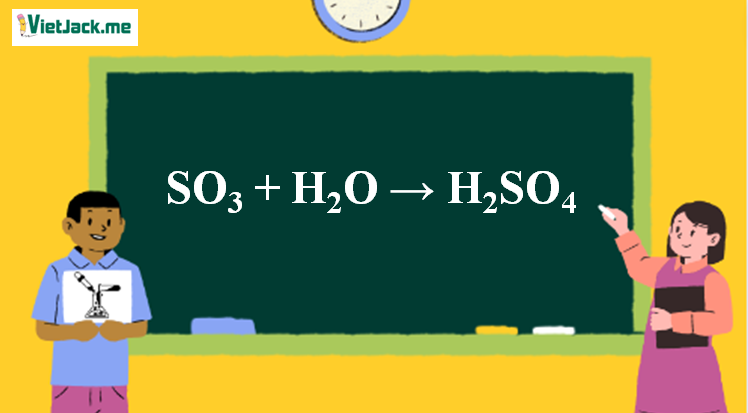
1. Phương trình SO3 ra H2SO4
SO3 + H2O → H2SO4
2. Điều kiện phản ứng SO3 ra H2SO4
Nhiệt độ thường
3. Bản chất của SO3 (Lưu huỳnh trioxit) trong phản ứng
SO3 có đầy đủ tính chất của một oxit axit tác dụng rất mạnh với nước tạo thành H2SO4.
4. Sản xuất H2SO4 trong công nghiệp
FeS2 → SO2 → SO3→ H2SO4
Phương trình hóa học
4FeS2 + 11O2 → 2Fe2O3 + 8SO2
2SO2 + O2(k) → 2SO3(k)
SO3 + H2O → H2SO4
5. Ứng dụng của H2S04
- Trong sản xuất phân bón
Axit sunfuric được dùng chính trong để sản xuất axit photphoric, một nguyên liệu không thể thiếu để sản xuất các loại phân photphat. Và nó cũng được dùng để sản xuất Amoni sunfat.
- Trong sản xuất công nghiệp:
H2SO4 được sử dụng rộng rãi trong sản xuất kim loại như đồng, kẽm,... và dùng để làm sạch bề mặt thép và dung dịch tẩy gỉ.
Axit sunfuric còn được dùng để sản xuất nhôm sunfat (phèn làm giấy), các loại muối sunfat, chế tạo thuốc nổ, thuốc nhuộm, chất dẻo, tẩy rửa kim loại trước mạ, sản xuất dược phẩm.
Hỗn hợp H2SO4 với nước được dùng làm chất điện giải trong các dạng ắc quy, axit chì,...
Mỗi năm có khoảng 160 triệu tấn H2SO4 được sử dụng, nổ bật trong các ngành sản xuất như phân bón 30%, chất tẩy rửa 14%, giấy, sợi 8%, chất dẻo 5%, luyện kim 2%, phẩm nhuộm 2%, ...
- Trong xử lý nước thải:
Axit sunfuric được sử dụng để sản xuất nhôm hidroxit, chất được dùng trong các nhà máy xử lý nước để lọc tạp chất, cải thiện mùi vị của nước, trung hòa độ pH trong nước, loại bỏ các Ca2+, Mg2+, có trong nước thải.
Lưu ý: Về tác hại của axit sunfuric, đây là hóa chất nguy hiểm, hạng một ăn mòn và gây bỏng rộp da. Vì thế khi sử dụng nên trang bị đầy đủ các dụng cụ chuyên dụng, mặt nạ phòng độc cá nhân, khẩu trang, tủ hút khio pha chế...
6. Lưu huỳnh trioxit SO3
6.1. Tính chất vật lí
Điều kiện thường, SO3 là chất lỏng, không màu.
Nhiệt độ nóng chảy: 17oC; nhiệt độ sôi: 45oC.
Tan vô hạn trong nước và trong axit H2SO4.
6.2. Tính chất hóa học SO3
Là 1 oxit axit
Tác dụng với nước → dung dịch axit
SO3 + H2O → H2SO4
Chú ý: H2SO4 là 1 axit mạnh và có tính oxi hóa mạnh.
Tác dụng với dung dịch bazơ (có thể tạo thành 2 loại muối sunfat và hiđrosunfat)
SO3 + KOH → KHSO4
SO3 + 2KOH → K2SO4 + H2O
SO3 + NaOH → có thể tạo 2 muối: muối axit hiđrosunfat (chứa ion HSO4-); muối trung hòa sunfat (chứa ion SO42-) tùy tỉ lệ.
Tác dụng với oxit bazơ → muối:
SO3 + BaO → BaSO4
6.3. Ứng dụng
Là sản phẩm trung gian để sản xuất axit H2SO4 có tầm quan trọng bậc nhất trong công nghiệp.
6.4. Điều chế
Trong công nghiệp:
Phương pháp: oxi hóa SO2ở nhiệt độ cao.
Phương trình hóa học: 2SO2+ O2 ⇄ 2SO3 (điều kiện: 450 – 500oC; xúc tác: V2O5)
6.5. Nhận biết
Thuốc thử: dung dịch BaCl2
Hiện tượng: xuất hiện kết tủa.
Phương trình hóa học: SO3 + H2O + BaCl2 → BaSO4↓ + 2HCl
7. Tính chất hóa học của H2O
7.1. Nước tác dụng với kim loại
Ở điều kiện thường, nước có thể phản ứng với các kim loại mạnh như Li, Ca, Na, K, Ba,… để tạo thành dung dịch Bazo và khí Hidro.
H2O + Kim loại → Bazơ + H2↑
2M + 2nH2O → 2M(OH)n + nH2↑
2Na + 2H2O → 2NaOH + H2
2K + 2H2O → 2KOH + H2
Ca + 2H2O → Ca(OH)2 + H2
Ba + 2H2O → Ba(OH)2 + H2
Đặc biệt, một số kim loại trung bình như Mg, Zn, Al, Fe,…phản ứng được với hơi nước ở nhiệt độ cao tạo ra oxit kim loại và hidro. Bên cạnh đó, kim loại Mg tan rất chậm trong nước nóng.
7.2. Nước tác dụng với oxit bazo
Nước tác dụng với một số oxit bazo như Na2O, CaO , K2O,… tạo thành dung dịch bazo tương ứng. Dung dịch bazo làm cho quỳ tím hóa xanh.
H2O + Oxit bazơ → Bazơ
Na2O + H2O → 2NaOH
Li2O + H2O→ 2LiOH
K2O + H2O→ 2KOH
CaO + H2O → Ca(OH)2
7.3. Nước tác dụng với oxit axit
Nước tác dụng với oxit axit tạo thành axit tương ứng. Dung dịch axit làm quỳ tím hóa đỏ.
H2O + Oxit axit → Axit
CO2 + H2O → H2CO3
SO2 + H2O → H2SO3
P2O5 + 3H2O → 2H3PO4
SO3 + H2O → H2SO4
N2O5 + H2O → 2HNO3
8. Bài tập vận dụng
Câu 1. Cho các nhận định sau :
(1). O3 có tính oxi hóa mạnh hơn O2.
(2). Ozon oxi hóa được Bạc và dung dịch KI.
(3). SO2 làm nhạt màu vàng của dd nước Brom.
(4). H2SO4 đặc rất háo nước và có tính oxi hóa mạnh.
(5). H2SO4 đặc hấp thụ SO3 tạo ra Oleum.
(6). Hiđro peoxit vừa có tính oxi hóa, vừa có tính khử.
(7). Lưu huỳnh đơn chất vừa có tính oxi hóa vừa có tính khử.
Số nhận định đúng là:
A. 4
B. 7
C. 5
D. 6
Lời giải:
Đáp án: B
Câu 2. Cho các chất sau: S, SO2, H2S, H2SO4, Cl2, HCl, O2, O3. Dãy gồm các chất vừa có thể đóng vai trò chất oxi hóa, vừa đóng vai trò chất khử trong các phản ứng hóa học là:
A. H2S, H2SO4, Cl2, HCl
B. S, SO2, Cl2, HCl
C. S, SO2, H2S, H2SO4
D. Cl2, O2, O3
Lời giải:
Đáp án: B
Giải thích:
Dãy gồm các chất vừa có thể đóng vai trò chất oxi hóa, vừa đóng vai trò chất khử trong các phản ứng hóa học là: S, SO2, Cl2, HCl.
Câu 3. Phản ứng nào sau đây lưu huỳnh đóng vai trò là chất oxi hoá?
A. S + O2 SO2
B. S + 2Na Na2S
C. S + 2H2SO4 → 3SO2 + 2H2O
D. S + 6HNO3 H2SO4 + 6NO2 + 2H2O
Lời giải:
Đáp án: B
Câu 4. Nhận định nào sau đây là đúng?
A. Kim loại có khả năng nhường electron tốt hơn rất nhiều so với phi kim
B. Bán kính của nguyên tử kim loại bé hơn so với bán kính của nguyên tử phi kim trong cùng một chu kì
C. Số electron lớp ngoài cùng của nguyên tử phi kim sẽ ít hơn số electron lớp ngoài cùng của kim loại
D. Độ âm điện của nguyên tử phi kim thường bé hơn nguyên tử kim loại
Lời giải:
Đáp án: A
Giải thích:
Vì trong 1 chu kì, kim loại có độ âm điện nhỏ hơn phi kim => nguyên tử kim loại thường có khả năng nhường electron tốt hơn rất nhiều so với phi kim
Câu 5. Sơ đồ điều chế H2SO4 trong công nghiệp là:
A. FeS2 → SO2 → SO3 → H2SO4
B. S → SO2 → SO3→ H2SO4
C. FeS2→ S → SO2 → SO3→ H2SO4
D. S → H2S →SO2 → SO3 → H2SO4
Lời giải:
Đáp án: A
Giải thích:
Phương trình hóa học
4FeS2 + 11O2→ 2Fe2O3 + 8SO2
2SO2 + O2 (k) → 2SO3 (k)
SO3 + H2O → H2SO4
Câu 6. Hòa tan hết m gam SO3 vào nước thu được 196 gam dung dịch axit sunfuric có nồng độ 15%. Khối lượng m gam SO3 là
A. 20g
B. 15g
C. 25g
D. 10g
Lời giải:
Đáp án: A
Giải thích:
nH2SO4= mH2SO4/MH2SO4= (196.12,5/100)/98 = 0,25 (mol)
⇒ nSO3= nH2SO4 = 0,25 (mol)
⇒ mSO3 = 0,25.80 = 20 g
Câu 7. Khi trộn lẫn dung dịch X chứa 1 mol H2SO4 vào dung dịch Y chứa 1 mol NaOH được dung dịch Z. Dung dịch Z làm quì tím chuyển sang:
A. Màu đỏ
B. Màu xanh
C. Không màu
D. Màu tím
Lời giải:
Đáp án: A
Câu 8. Dãy các chất nào sau đây tan trong nước?
A. Al2O3, CaO, P2O5, CuO, CO2
B. CuO, CaO, P2O5, CO, CO2
C. Na2O, CaO, P2O5, SO3, SO2
D. Fe2O3, BaO, SO2, SO3, SO2
Lời giải:
Đáp án: C
Câu 9. Khí sunfurơ được tạo ra từ cặp chất nào sau đây?
A. Muối natri sunfit và axit cacbonic
B. Muối natri sunfit và dung dịch axit clohiđric
C. Muối natri sunfat và dung dịch axit clohiđric
D. Muối natri sunfat và muối đồng (II) clorua
Lời giải:
Đáp án: B
Câu 10. Dãy oxit tác dụng với dung dịch H2SO4 loãng là:
A. MgO, Fe2O3, SO2, CuO.
B. Fe2O3, MgO, P2O5, K2O .
C. MgO, Fe2O3, CuO, K2O.
D. MgO, Fe2O3, SO2, P2O5.
Lời giải:
Đáp án: C
Câu 11. Dãy các chất tác dụng đuợc với nước tạo ra dung dịch bazơ là:
A. MgO, K2O, CuO, Na2O
B. CaO, Fe2O3, K2O, BaO
C. CaO, K2O, BaO, Na2O
D. Li2O, K2O, CuO, Na2O
Lời giải:
Đáp án: C
Giải thích:
C. CaO, K2O, BaO, Na2O
CaO + H2O → Ca(OH)2
K2O + H2O → 2KOH
BaO + H2O → Ba(OH)2
Na2O + H2O → 2NaOH
Câu 12. Kết luận nào sau đây không đúng khi nói về H2SO4?
A. H2SO4 loãng có đầy đủ tính chất chung của axit
B. Khi tiếp xúc với H2SO4 đặc dễ gây bỏng nặng
C. Khi pha loãng axit sunfuric, chỉ được cho từ từ nước vào axit
D. H2SO4 đặc là chất hút nước mạnh
Lời giải:
Đáp án: C
Giải thích:
Muốn pha loãng H2SO4 đặc, người ta rót từ từ axit vào nước và khuấy nhẹ bằng đũa thủy tinh mà không được làm ngược lại => Phát biểu C sai
Câu 13. Nhận xét nào sau đây không đúng về H2SO4?
A. H2SO4 tan tốt trong nước
B. Ở điều kiện thường H2SO4 là chất rắn.
C. H2SO4 có tính axit mạnh.
D. H2SO4 đặc có tính háo nước.
Lời giải:
Đáp án: B
Giải thích:
B. Ở điều kiện thường H2SO4 là chất lỏng
Câu 14. Dãy chất tác dụng với dung dịch H2SO4 loãng tạo thành dung dịch có màu xanh lam:
A. CuO, MgCO3
B. Cu, CuO
C. Cu(NO3)2, Cu
D. CuO, Cu(OH)2
Lời giải:
Đáp án: D
Giải thích:
A. Loại vì sinh ra MgSO4 không màu.
B,C. Loại vì Cu không phan ứng với dung dịch H2SO4.
D. Thỏa mãn vì cả 2 chất cùng phản ứng sinh ra muối CuSO4 có màu xanh lam
Pương trình hóa học: CuO + H2SO4 → CuSO4 + H2O
Cu(OH)2 + H2SO4 → CuSO4 + 2H2O
Xem thêm các phương trình phản ứng hóa học khác:
Xem thêm các chương trình khác:
- Các dạng bài tập Tiếng Anh thông dụng nhất
- 3000 câu hỏi ôn tập môn Tiếng Anh có đáp án
- Toàn bộ kiến thức về cụm động từ | Định nghĩa và cách dùng
- 500 đoạn văn Tiếng Anh thông dụng nhất và cách làm
- 1000 câu hỏi ôn tập môn Công nghệ có đáp án
- 1000 câu hỏi ôn tập Giáo dục công dân
- 15000 câu hỏi ôn tập môn Toán có đáp án
- Wiki Toán | Khái niệm, định lí, tính chất, dạng bài, công thức
- Tuyển tập đề thi + chuyên đề ôn thi Toán Kangaroo các cấp độ (có đáp án 2024)
- 3000 câu hỏi ôn tập môn Vật lí có đáp án
- Tổng hợp Dạng bài - Công thức môn Vật lí
- 2000 câu hỏi ôn tập môn Tin học có đáp án
- 3000 câu hỏi ôn tập môn Lịch sử có đáp án
- 3000 câu hỏi ôn tập môn Địa lí có đáp án
- 2000 câu hỏi ôn tập môn Sinh học có đáp án
- Tổng hợp Dạng bài - Công thức môn Sinh học
- Tổng hợp về các tác giả văn học
- 3000 câu hỏi ôn tập môn Ngữ văn có đáp án
- Tổng hợp kiến thức Ngữ Văn
- Tuyển tập truyện dân gian, truyền thuyết, cổ tích,... Việt Nam
- Tổng hợp các đề đọc - hiểu có đáp án chi tiết
- Trò chơi Powerpoint | Game Powerpoint
- Tổng hợp bài thu hoạch BDTX Giáo viên mầm non (2025) theo Thông tư 12
- Tổng hợp bài thu hoạch BDTX Giáo viên tiểu học (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THCS (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THPT (2025)
