CO2 + NaOH → NaHCO3 | CO2 ra NaHCO3 | NaOH ra NaHCO3
CO2 + NaOH → NaHCO3 là phản ứng trao đổi. Bài viết này cung cấp đầy đủ thông tin về phương trình hóa học đã được cân bằng, điều kiện các chất tham gia phản ứng, hiện tượng (nếu có), ... Mời các bạn đón xem:
Phản ứng CO2 + NaOH → NaHCO3
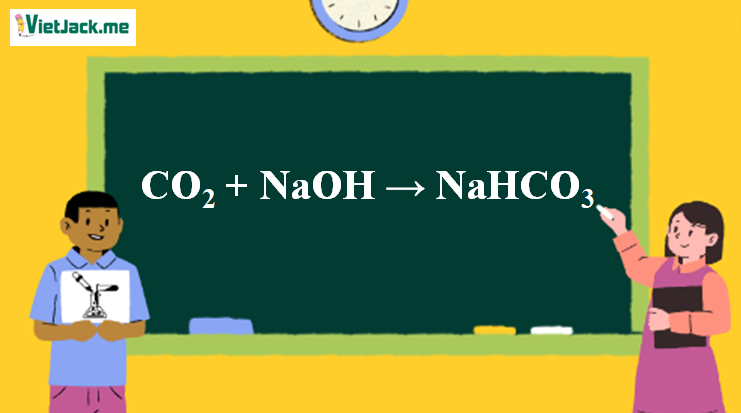
1. Phương trình phản ứng NaOH ra NaHCO3
CO2 + NaOH → NaHCO3
2. Điều kiện phản ứng CO2 ra NaHCO3
Khi cho CO2 tác dụng với dung dịch NaOH đều xảy ra 3 khả năng tạo muối:
CO2 + 2NaOH → Na2CO3+ H2O (1)
CO2 + NaOH → NaHCO3 (2)
Đặt T = nNaOH/nCO2
Nếu T = 2 : chỉ tạo muối Na2CO3
Nếu T = 1 : chỉ tạo muối NaHCO3
Nếu 1 < T < 2 : tạo cả muối NaHCO3 và Na2CO3
Như vậy để xảy ra phương trình phản ứng (1) thì T = 2
Để phản ứng CO2 tác dụng NaOH ra muối NaHCO3 thì số mol của NaOH và CO2 bằng nhau.
3. Bản chất của các chất tham gia phản ứng
3.1. Bản chất của CO2 (Cacbon dioxit)
CO2 là oxit axit tác dụng với dung dịch bazo tạo thành muối và nước.
3.2. Bản chất của NaOH (Natri hidroxit)
NaOH là một bazo mạnh phản ứng được với oxit axit.
4. Mở rộng kiến thức về CO2
4.1. Tính chất vật lý
- Là chất khí không màu, nặng gấp 1,5 lần không khí.
- Tan ít trong nước.
- CO2 khi bị làm lạnh đột ngột là thành phần chính của nước đá khô. Nước đá khô không nóng chảy mà thăng hoa nên được dùng để làm môi trường lạnh và khô, rất tiện lợi để bảo quản thực phẩm.
4.2. Tính chất hóa học
Khí CO2 không cháy, không duy trì sự cháy của nhiều chất.
a. CO2 là oxit axit
- CO2 tan trong nước tạo thành axit cacbonic (là một điaxit rất yếu):
CO2 (k) + H2O (l) ⇔ H2CO3 (dd)
- CO2 tác dụng với oxit bazơ → muối:
CaO + CO2 → CaCO3 (tº)
- CO2 tác dụng với dung dịch kiềm → muối + (H2O)
NaOH + CO2 → NaHCO3
2NaOH + CO2 → Na2CO3 + H2O
Phản ứng của CO2 với dung dịch kiềm tạo thành muối nào tuỳ thuộc vào tỉ lệ số mol của 2 chất tham gia phản ứng.
b. CO2 bền, ở nhiệt độ cao bị nhiệt phân một phần và tác dụng được với các chất khử mạnh
2CO2 ⇔ 2CO + O2 (tº)
CO2 + 2Mg → 2MgO + C (Đây là nguyên nhân không sử dụng CO2 để dập tắt các đám cháy kim loại)
CO2 + C → 2CO
c. CO2 còn được dùng để sản xuất ure
CO2 + 2NH3 → NH4O - CO - NH2 (amoni cacbamat)
NH4O - CO - NH2 → H2O + (NH2)2CO (180ºC; 200at)
4.3. Điều chế
- Quá trình hô hấp của người và động vật:
C6H12O6 + 6O2 → 6CO2 + 6H2O
- Quá trình lên men bia rượu:
C6H12O6 → 2CO2 + 2C2H5OH
- Quá trình đốt cháy nhiên liệu:
CxHy + (x + y/4)O2 → xCO2 + y/2 H2O
- Trong công nghiệp:
C + O2 → CO2 (đốt cháy hoàn toàn than cốc trong không khí)
CaCO3 → CaO + CO2 (1000ºC)
- Trong phòng thí nghiệm:
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
4.4. Ứng dụng
Khí co2 được dùng để làm lạnh, bảo quản thực phẩm, tạo ra nước soda và nhiều sản phẩm khác. Ngoài ra CO2 có vai trò trong quá trình quang hợp của thực vật và trong chu trình phát thải cacbon của Trái Đất. Khí co2 có tác dụng vô cùng trò quan trọng trong việc duy trì nhiệt độ trái đất, tạo ra sự chuyển hóa của các chất hữu cơ và tham gia vào nhiều quá trình công nghiệp khác.
5. Tính chất hóa học của NaOH
5.1. Làm đổi màu chất chỉ thị
Dung dịch NaOH làm quỳ tím chuyển thành màu xanh.
Dung dịch NaOH làm phenolphthalein không màu chuyển sang màu đỏ, đổi màu methyl da cam thành màu vàng.
5.2. Natri hidroxit tác dụng với oxit axit
Khi tác dụng với axit và oxit axit trung bình, yếu thì tùy theo tỉ lệ mol các chất tham gia mà muối thu được có thể là muối axit, muối trung hòa hay cả hai.
Phản ứng với oxit axit: NO2, SO2, CO2...
Ví dụ:
NaOH + CO2 → NaHCO3
2NaOH + CO2→ Na2CO3 + H2O
3NaOH + P2O5 → Na3PO4↓ + 3H2O
5.3. Natri hidroxit tác dụng với axit
Là một bazơ mạnh nên tính chất đặc trưng của NaOH là tác dụng với axit tạo thành muối tan và nước. Phản ứng này còn gọi là phản ứng trung hòa.
Ví dụ:
2NaOH + H2SO4 → Na2SO4 + 2H2O
3NaOH + H3PO4→ Na3PO4 + 3H2O
2NaOH + H2CO3 → Na2CO3 + 2H2O
5.4. Natri hidroxit tác dụng với muối
Natri hidroxit tác dụng với dung dịch muối tạo thành muối mới và bazơ mới.
Điều kiện để có phản ứng xảy ra: Muối tạo thành phải là muối không tan hoặc bazơ tạo thành phải là bazơ không tan.
Ví dụ:
2NaOH + MgCl2 → 2NaCl + Mg(OH)2
FeCl3 + 3NaOH → Fe(OH)3+ 3NaCl
5.5. Natri hidroxit tác dụng với một số phi kim như Si, C, P, S, Halogen
Si + 2NaOH + H2O → Na2SiO3 + 2H2↑
C + NaOH nóng chảy → 2Na + 2Na2CO3 + 3H2↑
5.6. Dung dịch NaOH có khả năng hoà tan một hợp chất của kim loại lưỡng tính Al, Zn, Be Sn Pb
Ví dụ: Al, Al2O3, Al(OH)3
2NaOH + 2Al + 2H2O → 2NaAlO2 + 3H2↑
2NaOH + Al2O3→ 2NaAlO2 + H2O
NaOH + Al(OH)3→ NaAlO2 + 2H2O
Chất được tạo ra trong dung dịch có thể chứa ion Na[Al(OH)4], hoặc có thể viết
Al(OH)3 + NaOH → Na[Al(OH)4]
Tương tự, NaOH có thể tác dụng với kim loại Be, Zn, Sb, Pb, Cr và oxit và hiđroxit tương ứng của chúng.
6. Bài tập vận dụng
Câu 1. Phản ứng giữa hai chất nào dưới đây không tạo thành khí lưu huỳnh đioxit?
A. Na2SO3 và HCl
B. Na2SO3 và Ca(OH)2
C. S và O2
D. FeS2 và O2
Lời giải:
Đáp án: B
Câu 2. Để nhận biết dung dịch NaOH và dung dịch Ba(OH)2 ta dùng thuốc thử là:
A. Phenolphtalein
B. Quỳ tím
C. dung dịch H2SO4
D. dung dịch HCl
Lời giải:
Đáp án: C
Câu 3. Hấp thụ hoàn toàn 4,48 lít CO2 (đktc) vào 500ml dung dịch NaOH 0,1M và Ba(OH)2 0,2M. Thì sinh ra m gam kết tủa. Giá trị của m
A. 19,7
B. 11,73
C. 9,85
D. 11,82
Lời giải:
Đáp án: C
Câu 4. Hấp thụ hoàn toàn 4,48 lít CO2 (đktc) vào 200ml dung dịch NaOH 1M. Sau phản ứng thu được muối
A. Na2CO3
B. NaHCO3
C. NaHCO3và NaHCO3
D. Na2CO3 dư NaOH
Lời giải:
Đáp án: B
Xem thêm các phương trình phản ứng hóa học khác:
Xem thêm các chương trình khác:
- Các dạng bài tập Tiếng Anh thông dụng nhất
- 3000 câu hỏi ôn tập môn Tiếng Anh có đáp án
- Toàn bộ kiến thức về cụm động từ | Định nghĩa và cách dùng
- 500 đoạn văn Tiếng Anh thông dụng nhất và cách làm
- 1000 câu hỏi ôn tập môn Công nghệ có đáp án
- 1000 câu hỏi ôn tập Giáo dục công dân
- 15000 câu hỏi ôn tập môn Toán có đáp án
- Wiki Toán | Khái niệm, định lí, tính chất, dạng bài, công thức
- Tuyển tập đề thi + chuyên đề ôn thi Toán Kangaroo các cấp độ (có đáp án 2024)
- 3000 câu hỏi ôn tập môn Vật lí có đáp án
- Tổng hợp Dạng bài - Công thức môn Vật lí
- 2000 câu hỏi ôn tập môn Tin học có đáp án
- 3000 câu hỏi ôn tập môn Lịch sử có đáp án
- 3000 câu hỏi ôn tập môn Địa lí có đáp án
- 2000 câu hỏi ôn tập môn Sinh học có đáp án
- Tổng hợp Dạng bài - Công thức môn Sinh học
- Tổng hợp về các tác giả văn học
- 3000 câu hỏi ôn tập môn Ngữ văn có đáp án
- Tổng hợp kiến thức Ngữ Văn
- Trò chơi Powerpoint | Game Powerpoint
- Tổng hợp bài thu hoạch BDTX Giáo viên mầm non (2024) theo Thông tư 12
- Tổng hợp bài thu hoạch BDTX Giáo viên tiểu học (2024)
- Tổng hợp bài thu hoạch BDTX Giáo viên THCS (2024)
- Tổng hợp bài thu hoạch BDTX Giáo viên THPT (2024)
