Zn + NaOH + H2O → Na2[Zn(OH)4] + H2 | Zn ra Na2[Zn(OH)4]
Zn + NaOH + H2O → Na2[Zn(OH)4] + H2 là Phản ứng oxi hóa khử. Bài viết này cung cấp đầy đủ thông tin về phương trình hóa học đã được cân bằng, điều kiện các chất tham gia phản ứng, hiện tượng (nếu có), ... Mời các bạn đón xem:
Phản ứng Zn + NaOH + H2O → Na2[Zn(OH)4] + H2
![Zn + NaOH + H2O → Na2[Zn(OH)4] + H2 | Zn ra Na2[Zn(OH)4] (ảnh 1)](https://vietjack.me/storage/uploads/images/299/7-1679133331.png)
1. Phương trình phản ứng Zn tác dụng NaOH
Zn + 2NaOH + 2H2O → Na2[Zn(OH)4] + H2
2. Điều kiện phản ứng xảy ra
Nhiệt độ thường
3. Bản chất của Zn (Kẽm) trong phản ứng
Zn tác dụng với dung dịch bazơ mạnh: NaOH, KOH, Ca(OH)2....
4. Tính chất hoá học của Zn
Kẽm là kim loại hoạt động có tính khử mạnh Zn → Zn2+ + 2e
4.1. Tác dụng với phi kim
Zn tác dụng trực tiếp với nhiều phi kim.
2Zn + O2 → 2ZnO
Zn + Cl2 → ZnCl2
4.2. Tác dụng với axit
- Với các dung dịch axit HCl, H2SO4 loãng:
Zn + 2HCl → ZnCl2 + H2
- Với dung dịch HNO3, H2SO4 đặc:
Zn + 4HNO3 đ → Zn(NO3)2 + 2NO2 + 2H2O
4.3. Tác dụng với H2O
Phản ứng này hầu như không xảy ra vì trên bề mặt của kẽm có màng oxit bảo vệ.
4.4. Tác dụng với bazơ
Kẽm tác dụng với dung dịch bazơ mạnh: NaOH, KOH, Ca(OH)2....
Zn + 2NaOH + 2H2O → Na2[Zn(OH)4] + H2
4.5. Điều chế
Kẽm là nguyên tố được sử dụng phổ biến thứ 4, sau sắt, đồng, nhôm. Khoảng 70% lượng kẽm hiện nay đến từ việc khai thác quặng kẽm, phần còn lại sẽ từ hoạt động tái chế. 95% kẽm khai thác từ quặng sulfit. Trên thế giới các mỏ quặng kẽm tập trung nhiều tại Trung Quốc, Peru và Australia.
Quặng kẽm sẽ được nghiền nhỏ và trải qua nhiều công đoạn xử lý, tinh chế để thu được kim loại kẽm tinh khiết:
Chuyển kẽm sulfit thành kẽm oxit: 2 ZnS + 3 O2 → 2 ZnO + 2 SO2.
Khử kẽm oxit với cacbon hoặc CO ở 950 °C tạo kim loại kẽm ở dạng hơi. Hơi kẽm được thu hồi trong bình ngưng tụ:
2 ZnO + C → 2 Zn + CO2
2 ZnO + 2 CO → 2 Zn + 2 CO2.
Ngoài ra có thể khử ZnO bằng phương pháp sử dụng dung dịch H2SO4 sau đó điện phân thu kẽm kim loại:
ZnO + H2SO4 → ZnSO4 + H2O
2 ZnSO4 + 2 H2O → 2 Zn + 2 H2SO4 + O2
5. Tính chất hoá học của NaOH
NaOH là một bazơ mạnh nó sẽ làm quỳ tím chuyển màu xanh, còn dung dịch phenolphtalein thành màu hồng. Một số phản ứng đặc trưng của Natri Hidroxit được liệt kê ngay dưới đây.
Phản ứng với axit tạo thành muối + nước:
NaOHdd + HCldd→ NaCldd + H2O
Phản ứng với oxit axit: SO2, CO2…
2 NaOH + SO2→ Na2SO3 + H2O
NaOH + SO2→ NaHSO3
Phản ứng với axit hữu cơ tạo thành muối và thủy phân este, peptit:
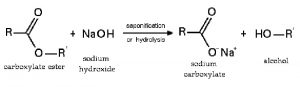
Phản ứng với muối tạo bazo mới + muối mới (điều kiện: sau phản ứng phải tạo thành chất kết tủa hoặc bay hơi):
2 NaOH + CuCl2→ 2NaCl + Cu(OH)2↓
Tác dụng với kim loại lưỡng tính:
2 NaOH + 2Al + 2H2O→ 2NaAlO2 + 3H2↑
2NaOH + Zn → Na2ZnO2 + H2↑
Tác dụng với hợp chất lưỡng tính:
NaOH + Al(OH)3 → NaAl(OH)4
2NaOH + Al2O3 → 2NaAlO2 + H2O
6. Bài tập vận dụng liên quan
Câu 1. Oxit nào dưới đây phản ứng được với HCl lẫn NaOH.
A. CaO
B. FeO
C. ZnO
D. MgO
Lời giải:
Câu 2. Cho dung dịch chứa FeCl2 và ZnCl2 tác dụng với dung dịch KOH dư, sau đó lấy kết tủa nung trong không khí đến khối lượng không đổi thu được chất rắn gồm:
A. Fe2O3, ZnO
B. FeO
C. Fe3O4, ZnO
D. Fe2O3
Lời giải:
FeCl2 + 2KaOH → Fe(OH)2 + 2KCl
ZnCl2 + 4KOH dư → K2ZnO2 + 2KCl + 2H2O
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3
Fe(OH)3 → Fe2O3 + H2O
Vậy chất rắn sau phản ứng là Fe2O3
Câu 3. Ngâm một lá Zn vào dung dịch HCl thấy bọt khí thoát ra ít và chậm. Nếu nhỏ thêm vào vài giọt dung dịch X thì thấy bọt khí thoát ra rất nhiều và nhanh. Chất tan trong dung dịch X là
A. H2SO4.
B. FeSO4.
C. KOH.
D. Al2(SO4)3
Lời giải:
Chất tan trong X là FeSO4 vì khi nhỏ FeSO4 vào xảy ra phản ứng:
Zn + FeSO4 → ZnSO4 + Fe
Fe bám vào lá Zn tạo thành cặp điện cực Zn - Fe cùng nhúng trong dung dịch điện li nên có xảy ra sự ăn mòn điện hóa nên khiến cho bọt khí thoát ra nhiều và nhanh hơn.
Xem thêm các phương trình hóa học khác:
Xem thêm các chương trình khác:
- Các dạng bài tập Tiếng Anh thông dụng nhất
- 3000 câu hỏi ôn tập môn Tiếng Anh có đáp án
- Toàn bộ kiến thức về cụm động từ | Định nghĩa và cách dùng
- 500 đoạn văn Tiếng Anh thông dụng nhất và cách làm
- 1000 câu hỏi ôn tập môn Công nghệ có đáp án
- 1000 câu hỏi ôn tập Giáo dục công dân
- 15000 câu hỏi ôn tập môn Toán có đáp án
- Wiki Toán | Khái niệm, định lí, tính chất, dạng bài, công thức
- Tuyển tập đề thi + chuyên đề ôn thi Toán Kangaroo các cấp độ (có đáp án 2024)
- 3000 câu hỏi ôn tập môn Vật lí có đáp án
- Tổng hợp Dạng bài - Công thức môn Vật lí
- 2000 câu hỏi ôn tập môn Tin học có đáp án
- 3000 câu hỏi ôn tập môn Lịch sử có đáp án
- 3000 câu hỏi ôn tập môn Địa lí có đáp án
- 2000 câu hỏi ôn tập môn Sinh học có đáp án
- Tổng hợp Dạng bài - Công thức môn Sinh học
- Tổng hợp về các tác giả văn học
- 3000 câu hỏi ôn tập môn Ngữ văn có đáp án
- Tổng hợp kiến thức Ngữ Văn
- Tuyển tập truyện dân gian, truyền thuyết, cổ tích,... Việt Nam
- Trò chơi Powerpoint | Game Powerpoint
- Tổng hợp bài thu hoạch BDTX Giáo viên mầm non (2025) theo Thông tư 12
- Tổng hợp bài thu hoạch BDTX Giáo viên tiểu học (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THCS (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THPT (2025)
