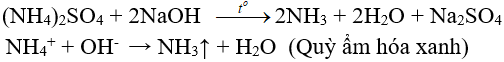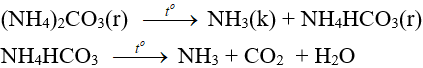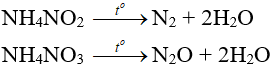NH4Cl + Ba(OH)2 → BaCl2 + NH3 + H2O | NH4Cl ra NH3
NH4Cl + Ba(OH)2 → BaCl2 + NH3 + H2O là phản ứng trao đổi. Bài viết này cung cấp đầy đủ thông tin về phương trình hóa học đã được cân bằng, điều kiện các chất tham gia phản ứng, hiện tượng (nếu có), ... Mời các bạn đón xem:
Phản ứng NH4Cl + Ba(OH)2 → BaCl2 + NH3 + H2O
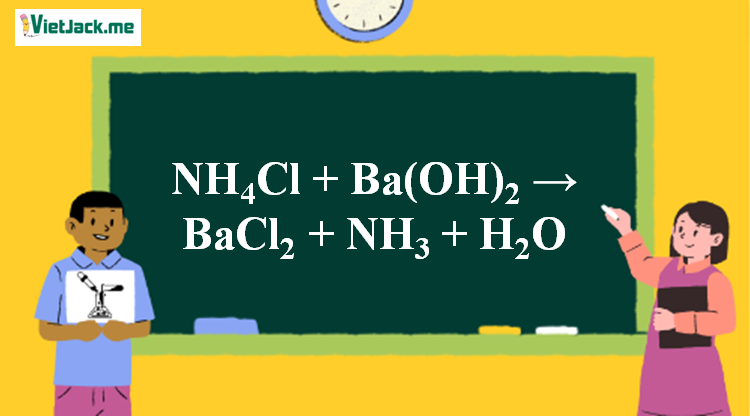
1. Phương trình NH4Cl tác dụng với Ba(OH)2
2NH4Cl + Ba(OH)2 BaCl2 + 2NH3 ↑ + 2H2O
2. Điều kiện phương trình phản ứng NH4Cl ra NH3
Nhiệt độ
3. Bản chất của các chất tham gia phản ứng
3.1. Bản chất của NH4Cl (Amoni clorua)
Amoni clorua là muối của axit yếu nên có khả năng phản ứng với bazo mạnh như NaOH để giải phóng khí amoniac.
3.2. Bản chất của Ba(OH)2 (Bari hidroxit)
Ba(OH)2 là một bazo mạnh phản ứng với muối NH4Cl khi đun nóng và có khí mùi khai bay ra.
4. Tính chất hoá học của muối amoni
4.1.Phản ứng thuỷ phân
Tạo môi trường có tính axit làm quỳ tím hoá đỏ.
NH4+ + HOH → NH3 + H3O+ (Tính axit)
4.2. Tác dụng với dung dịch kiềm
(nhận biết ion amoni, điều chế amoniac trong phòng thí nghiệm)
4.3. Phản ứng nhiệt phân
- Muối amoni chứa gốc của axit không có tính oxi hóa khi nung nóng bị phân hủy thành NH3.
NH4HCO3 (bột nở) được dùng làm xốp bánh.
- Muối amoni chứa gốc của axit có tính oxi hóa khi bị nhiệt phân cho ra N2, N2O.
- Nhiệt độ lên tới 500oC, ta có phản ứng:
2NH4NO3 → 2N2 + O2 + 4H2O
5. Ứng dụng của NH4Cl
Ứng dụng chính của amoni chloride là nguồn cung cấp nitơ trong phân bón (tương ứng với 90% sản lượng amoni chloride thế giới) như amoni clorophotphat. Các loại cây trồng dùng phân bón này chủ yếu là lúa ở châu Á.
Amoni chloride đã được sử dụng trong pháo hoa vào thế kỷ 18 nhưng đã được thay thế bằng các chất an toàn hơn và ít hút ẩm hơn. Mục đích của nó là để cung cấp nguồn clo để tăng cường màu xanh lá cây và màu xanh da trời từ ion đồng trong ngọn lửa.
Amoni chloride đã được sử dụng một thời để tạo ra khói trắng, nhưng phản ứng phân hủy kép tức thời của nó với kali clorat tạo ra hợp chất amoni clorat với tính ổn định không cao đã làm cho việc sử dụng chất này rất hạn chế
6. Tính chất hóa học của Ba(OH)2
Mang đầy đủ tính chất hóa học của một bazơ mạnh.
Phản ứng với các axit:
Ba(OH)2 + 2HCl → BaCl2+ 2H2O
Phản ứng với oxit axit: SO2, CO2...
Ba(OH)2 + SO2 → BaSO3 + H2O
Ba(OH)2 + 2SO2 → Ba(HSO3)2
Phản ứng với các axit hữu cơ tạo thành muối:
2CH3COOH + Ba(OH)2 → (CH3COO)2Ba + 2H2O
Phản ứng thủy phân este:
2CH3COOC2H5 + Ba(OH)2 → (CH3COO)2Ba + 2 C2H5OH
Phản ứng với muối:
Ba(OH)2 + CuCl2 → BaCl2 + Cu(OH)2↓
Tác dụng một số kim loại mà oxit, hidroxit của chúng có tính lưỡng tính (Al, Zn...):
Ba(OH)2 + 2Al + 2H2O → Ba(AlO2)2 + 3H2↑
Tác dụng với hợp chất lưỡng tính:
Ba(OH)2 + 2Al(OH)3 → Ba(AlO2)2 + 4H2O
Ba(OH)2 + Al2O3 → Ba(AlO2)2 + H2
7. Bài tập vận dụng liên quan Amoniac
Câu 1. Cho dãy các chất: (NH4)2SO4, NaCl, FeCl2, AlCl3. Số chất trong dãy tác dụng với lượng dư dung dịch Ba(OH)2 tạo thành kết tủa là
A. 4.
B. 2.
C. 1.
D. 3.
Lời giải:
Câu 2. Dung dịch chất nào sau đây tác dụng với dung dịch Ba(OH)2 tạo ra kết tủa?
A. NaCl
B. Ca(HCO3)2
C. KCl
D. KNO3
Lời giải:
Câu 3. Trộn lẫn dd muối (NH4)2SO4 với dung dịch Ba(NO2)2 rồi đun nóng thì thu được chất khí X. X là:
A. NO2
B. N2
C. NO
D. N2O
Lời giải:
Câu 4. Cho 2,92 gam hỗn hợp X gồm NH4NO3 và (NH4)2SO4 tác dụng vừa đủ với 400 ml dung dịch KOH thu được 0,896 lít khí. Tìm pH của dung dịch KOH đã dùng.
A. 11
B. 12
C. 13
D. 14
Lời giải:
Xem thêm các phương trình hóa học khác:
Xem thêm các chương trình khác:
- Các dạng bài tập Tiếng Anh thông dụng nhất
- 3000 câu hỏi ôn tập môn Tiếng Anh có đáp án
- Toàn bộ kiến thức về cụm động từ | Định nghĩa và cách dùng
- 500 đoạn văn Tiếng Anh thông dụng nhất và cách làm
- 1000 câu hỏi ôn tập môn Công nghệ có đáp án
- 1000 câu hỏi ôn tập Giáo dục công dân
- 15000 câu hỏi ôn tập môn Toán có đáp án
- Wiki Toán | Khái niệm, định lí, tính chất, dạng bài, công thức
- Tuyển tập đề thi + chuyên đề ôn thi Toán Kangaroo các cấp độ (có đáp án 2024)
- 3000 câu hỏi ôn tập môn Vật lí có đáp án
- Tổng hợp Dạng bài - Công thức môn Vật lí
- 2000 câu hỏi ôn tập môn Tin học có đáp án
- 3000 câu hỏi ôn tập môn Lịch sử có đáp án
- 3000 câu hỏi ôn tập môn Địa lí có đáp án
- 2000 câu hỏi ôn tập môn Sinh học có đáp án
- Tổng hợp Dạng bài - Công thức môn Sinh học
- Tổng hợp về các tác giả văn học
- 3000 câu hỏi ôn tập môn Ngữ văn có đáp án
- Tổng hợp kiến thức Ngữ Văn
- Tuyển tập truyện dân gian, truyền thuyết, cổ tích,... Việt Nam
- Tổng hợp các đề đọc - hiểu có đáp án chi tiết
- Trò chơi Powerpoint | Game Powerpoint
- Tổng hợp bài thu hoạch BDTX Giáo viên mầm non (2025) theo Thông tư 12
- Tổng hợp bài thu hoạch BDTX Giáo viên tiểu học (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THCS (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THPT (2025)