FeCl2 + AgNO3 → Fe(NO3)2 + AgCl | FeCl2 ra Fe(NO3)2 | AgNO3 ra AgCl
FeCl2 + AgNO3 → Fe(NO3)2 + AgCl là phản ứng trao đổi. Bài viết này cung cấp đầy đủ thông tin về phương trình hóa học đã được cân bằng, điều kiện các chất tham gia phản ứng, hiện tượng (nếu có), ... Mời các bạn đón xem:
Phản ứng FeCl2 + AgNO3 → Fe(NO3)2 + AgCl
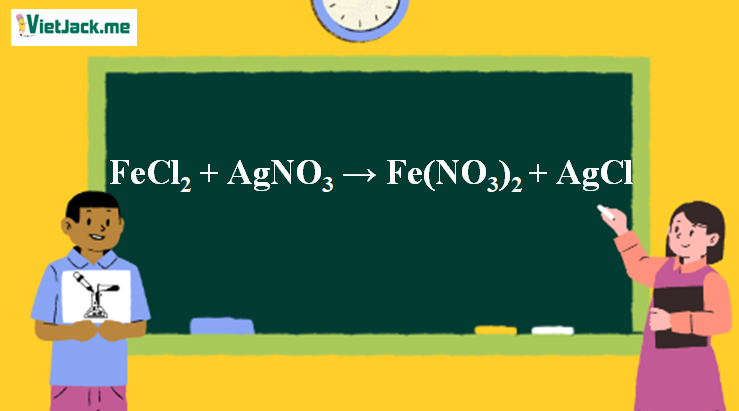
1. Phương trình phản ứng FeCl2 tác dụng AgNO3
FeCl2 + 2AgNO3 → Fe(NO3)2 + 2AgCl↓trắng
2. Điều kiện phản ứng FeCl2 tác dụng với AgNO3
Không có
3. Cách tiến hành phản ứng FeCl2+ AgNO3
cho AgNO3 tác dụng với dung dịch muối FeCl2
4. Hiện tượng sau phản ứng FeCl2 tác dụng với AgNO3
Xuất hiện kết tủa trắng bạc clorua (AgCl).
5. Một số thông tin về muối sắt (II) clorua
Sắt(II) clorua là tên gọi để chỉ một hợp chất được tạo bởi sắt và 2 nguyên tử clo. Thường thu được ở dạng chất rắn khan.
Công thức phân tử: FeCl2
5.1. Tính chất vật lý sắt (II) clorua
Nó là một chất rắn thuận từ có nhiệt độ nóng chảy cao, và thường thu được dưới dạng chất rắn màu trắng. Tinh thể dạng khan có màu trắng hoặc xám; dạng ngậm nước FeCl2.4H2O có màu xanh nhạt. Trong không khí, dễ bị chảy rữa và bị oxi hoá thành sắt (III).
Nhận biết: Sử dụng dung dịch AgNO3, thấy xuất hiện kết tủa trắng.
FeCl2 + 2AgNO3 → Fe(NO3)2 + 2AgCl↓
5.2. Tính chất hóa học sắt (II) clorua
Mang đầy đủ tính chất hóa học của muối.
Có tính khử Fe2+ → Fe3+ + 1e
- Tính chất hóa học của muối
Tác dụng với dung dịch kiềm:
FeCl2+ 2NaOH → Fe(OH)2 + 2NaCl
Tác dụng với muối
FeCl2 + 2AgNO3→ Fe(NO3)2+ 2AgCl
- Tính khử
Thể hiện tính khử khi tác dụng với các chất oxi hóa mạnh:
2FeCl2 + Cl2 → 2FeCl3
3FeCl2 + 10HNO3→ 3Fe(NO3)3 + NO + 2H2O + 6HCl
5.3. Điều chế Sắt (II) clorua
Cho kim loại Fe tác dụng với axit HCl:
Fe + 2HCl → FeCl2 + H2
Cho sắt (II) oxit tác dụng với HCl
FeO + 2HCl → FeCl2 + H2O
6. Mở rộng kiến thức về AgNO3
6.1. Tính chất vật lí & nhận biết
- Tính chất vật lí: Là chất rắn, có màu trắng, tan tốt trong nước, có nhiệt độ nóng chảy là 212oC.
- Nhận biết: Sử dụng muối NaCl, thu được kết tủa trắng
AgNO3 + NaCl →AgCl↓+ NaNO3
6.2. Tính chất hóa học
Mang tính chất hóa học của muối
Tác dụng với muối
AgNO3 + NaCl →AgCl↓+ NaNO3
2AgNO3 + BaCl2 →2AgCl↓+ Ba(NO3)2
Tác dụng với kim loại:
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag
Tác dụng với axit:
AgNO3 + HI → AgI ↓ + HNO3
Oxi hóa được muối sắt (II)
Fe(NO3)2 + AgNO3 → Fe(NO3)3 + Ag
6.3. Điều chế
Bạc nitrat điều chế bằng cách hòa tan kim loại bạc trong dung dịch axit nitric.
3Ag + 4 HNO3(loãng) → 3AgNO3 + 2H2O + NO
3Ag + 6 HNO3(đặc, nóng) → 3AgNO3 + 3 H2O + 3NO2
6.4. Ứng dụng
- Trong công nghiệp:
AgNO3 được sử dụng để sản xuất muối bạc khác.
AgNO3 được sử dụng để tạo ra chất kết dính dẫn điện, máy lọc khí mới, sàng phân tử A8x , quần áo cân bằng áp suất mạ bạc và găng tay để làm việc trực tiếp.
AgNO3 được sử dụng để làm vật liệu nhạy sáng cho phim, phim x-quang và phim ảnh.
AgNO3 sử dụng để mạ bạc các linh kiện điện tử và thủ công mỹ nghệ khác và cũng được sử dụng rộng rãi làm vật liệu mạ bạc cho gương và phích nước.
AgNO3 được sử dụng để sản xuất pin bạc-kẽm.
- Ứng dụng trong y học:
AgNO3 được sử dụng trong y học để ăn mòn mô hạt tăng sinh và dung dịch loãng được sử dụng làm thuốc diệt nấm cho nhiễm trùng mắt.
Ứng dụng khác:
Dung dịch bạc nitrat có thể được khử bằng chất khử hữu cơ aldehyd và đường. Do đó, nó là một tác nhân để phát hiện aldehyd và đường. Nó cũng được sử dụng để đo các ion clorua, chất xúc tác để xác định mangan, mạ điện, chụp ảnh và tô màu sứ.
7. Bài tập vận dụng liên quan
Câu 1. Trong các phản ứng sau, phản ứng nào HNO3 không đóng vai trò chất oxi hóa?
A. ZnS + HNO3(đặc nóng)
B. Fe2O3 + HNO3(đặc nóng)
C. FeSO4 + HNO3(loãng)
D. Cu + HNO3 (đặc nóng)
Lời giải:
Phương trình phản ứng hóa học
Fe2O3 + 6HNO3→ 2Fe(NO3)3 + 3H2O
Trong phản ứng này HNO3 đóng vai trò như một axit thông thường.
Câu 2. HNO3 phản ứng với tất cả các chất trong nhóm nào sau đây?
A. NH3, Al2O3, Cu2S, BaSO4.
B. Cu(OH)2, BaCO3, Au, Fe2O3.
C. CuS, Pt, SO2, Ag.
D. Fe(NO3)2, S, NH4HCO3, Mg(OH)2.
Lời giải:
NO3 phản ứng với tất cả các chất trong nhóm: Fe(NO3)2, S, NH4HCO3, Mg(OH)2.
Phương trình phản ứng hóa học minh họa
Fe(NO3)2 + 2HNO3 → Fe(NO3)3 + NO2 + H2O
S + 2HNO3 → H2SO4 + 2NO
15NH4HCO3 + 5HNO3 → 10NH4NO3 + 2H2O + 15CO2
Mg(OH)2 + 2HNO3 → Mg(NO3)2 + 2H2O
Câu 3. Có các mệnh đề sau:
(1) Các muối nitrat đều tan trong nước và đều là chất điện li mạnh.
(2) Ion NO có tính oxi hóa trong môi trường axit.
(3) Khi nhiệt phâm muối nitrat rắn ta đều thu được khí NO2
(4) Hầu hết muối nitrat đều bền nhiệt.
Trong các mệnh đè trên, những mệnh đề đúng là
A. (1) và (3).
B. (2) và (4).
C. (2) và (3).
D. (1) và (2).
Lời giải:
(1) đúng Các muối nitrat đều tan trong nước và đều là chất điện li mạnh.
(2) đúng Ion NO có tính oxi hóa trong môi trường axit.
(3) sai vì muối nitrat của K, Na, Ba, Ca nhiệt phân không thu được khí NO2
(4) sai vì các muối nitrat hầu hết kém bền nhiệt
Câu 4. Cho dung dịch KOH vào ống nghiệm đựng dung dịch FeCl3, hiện tượng quan sát được là:
A. Có kết tủa trắng xanh.
B. Có khí thoát ra.
C. Có kết tủa đỏ nâu.
D. Kết tủa màu trắng.
Lời giải:
Cho dung dịch KOH vào ống nghiệm đựng dung dịch FeCl3, hiện tượng quan sát được là: Có kết tủa đỏ nâu.
Phương trình phản ứng minh họa
3KOH + FeCl3 → Fe(OH)3↓+ 3KCl
Fe(OH)3 kết tủa màu nâu đỏ
Câu 5. Dung dịch của chất X có pH > 7 và khi cho tác dụng với dung dịch kali sunfat (K2SO4) tạo ra chất không tan (kết tủa). Chất X là:
A. BaCl2
B. NaOH
C. Ba(OH)2
D. H2SO4
Lời giải:
Dung dịch chất X có pH > 7 => X là dung dịch bazơ => loại A và D
Dung dịch X tác dụng với dung dịch K2SO4 tạo kết tủa => X là Ba(OH)2
Ba(OH)2 + K2SO4 → BaSO4↓ + 2KOH
Câu 6. Cho sơ đồ phản ứng sau: Fe → muối A1 → muối A2 → muối A3 → Fe
A1, A2, A3 là các muối của sắt (II)
Theo thứ tự A1, A2, A3 lần lượt là:
A. FeCO3, Fe(NO3)2, FeSO4
B. FeS, Fe(NO3)2, FeSO4
C. Fe(NO3)2, FeCO3, FeSO4
D. FeCl2, FeSO4, FeS
Lời giải:
Phương trình phản ứng minh họa
Fe + Cu(NO3)2→ Fe(NO3)2 + Cu
Fe(NO3)2 + Na2CO3 → FeCO3 + 2NaNO3
FeCO3 + H2SO4 → FeSO4 + CO2 + H2O
2Al + 3FeSO4 → Al2(SO4)3 + 3Fe
Câu 7. Cho 3,36 gam bột sắt vào 300 ml dung dịch chứa hỗn hợp gồm AgNO3 0,1M và Cu(NO3)2 0,5M. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch X và m gam chất rắn Y. Giá trị của m là
A. 6,12.
B. 3,24.
C. 0,96.
D. 4,2.
Lời giải:
nFe = = 0,06 mol
nAgNO3 = 0,1.0,3 = 0,03 mol
nCu(NO3)2 = 0,5.0,3 = 0,15 mol
Thứ tự các phương trình phản ứng :
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag
0,015 ← 0,03 → 0,015 → 0,03
=> nFe còn = 0,06 – 0,015 = 0,045 mol
Fe + Cu(NO3)2 → Fe(NO3)2 + Cu
0,045 → 0,045 → 0,045 => nCu(NO3)2 dư = 0,15 – 0,045 = 0,105 mol
Vậy chất rắn gồm: 0,03 mol Ag và 0,045 mol Cu
=> m = 0,03.108 + 0,045.64 = 6,12 g
Câu 8. Cho m gam bột sắt vào dung dịch hỗn hợp gồm 0,15 mol CuSO4 và 0,2 mol HCl. Sau khi các phản ứng xảy ra hoàn toàn, thu được 0,725m gam hỗn hợp kim loại. Giá trị của m là
A. 16,0.
B. 11,2.
C. 16,8.
D. 18,0.
Lời giải:
Phương trình ion
Fe + Cu2+ → Fe2+ + Cu
Phương trình phản ứng hóa học
Fe + 2HCl → FeCl2 + H2
Theo 2 phương trình (1) và (2) ta có:
nFe pư = nCu2+ + 0,5nHCl = 0,15 + = 0,25 mol
nCu = nCu2+ = 0,15 mol
=> m KL sau phản ứng = mFe bđ– mFe pư + mCu
=> m – 0,25.56 + 0,15.64 = 0,725m => m = 16 gam
Câu 9. Những nhận định sau về kim loại sắt:
(1) Kim loại sắt có tính khử trung bình.
(2) Ion Fe2+ bền hơn Fe3+.
(3) Fe bị thụ động trong H2SO4 đặc nguội.
(4) Quặng manhetit là quặng có hàm lượng sắt cao nhất.
(5) Trái đất tự quay và sắt là nguyên nhân làm Trái Đất có từ tính.
(6) Kim loại sắt có thể khử được ion Fe3+.
Số nhận định đúng là
A. 3
B. 4
C. 5
D. 6
Lời giải:
(1) đúng
(2) sai, Fe2+ trong không khí dễ bị oxi hóa thành Fe3+
(3) đúng
(4) đúng, quặng manhetit (Fe3O4) là quặng có hàm lượng Fe cao nhất.
(5) sai, vì từ trường Trái Đất sinh ra do sự chuyển động của các chất lỏng dẫn điện
(6) đúng, Fe + 2Fe3+ → 3Fe2+
Vậy có 4 phát biểu đúng
Câu 10. Sắt có thể tác dụng được với tất cả các chất trong dãy nào sau đây?
A. CuSO4, Cl2, HNO3 đặc nguội, HCl.
B. Mg(NO3)2, O2, H2SO4 loãng, S.
C. AgNO3, Cl2, HCl, NaOH.
D. Cu(NO3)2, S, H2SO4 loãng, O2.
Lời giải:
Sắt có thể tác dụng được với tất cả các chất là Cu(NO3)2, S, H2SO4 loãng, O2.
Fe + Cu(NO3)2 → Fe(NO3)2 + Cu
Fe + S → FeS
Fe + H2SO4 → FeSO4 + H2 ↑
3Fe + 2O2 → Fe3O4
Câu 11. Dãy gồm các chất đều phản ứng được với Fe(NO3)2 là:
A. NaOH, Mg, KCl, H2SO4.
B. AgNO3, Br2, NH3, HCl.
C. AgNO3, NaOH, Cu, FeCl3
D. KCl, Br2, NH3, Zn.
Lời giải:
A. Loại KCl không pư
B. Thỏa mãn
AgNO3 + Fe(NO3)2 → Fe(NO3)3 + Ag↓
3Br2 + 3Fe(NO3)2→ Fe(NO3)3 + 2FeBr3
2NH3 + 2H2O + Fe(NO3)2 → Fe(OH)2 + 2NH4NO3
12HCl + 9Fe(NO3)2 → 5Fe(NO3)3 + 4FeCl3 + 3NO + 6H2O
C. Loại Cu, FeCl3
D. Loại KCl
Câu 12. Dung dịch X có chứa FeSO4, dung dịch Y có chứa Fe2(SO4)3. Thuốc thử nào sau đây có thể sử dụng để phân biệt X và Y là
A. dung dịch NH3.
B. dung dịch KMnO4 trong H2SO4.
C. kim loại Cu
D. tất cả các đáp án trên.
Lời giải:
Dung dịch X có chứa FeSO4, dung dịch Y có chứa Fe2(SO4)3. Thuốc thử nào sau đây có thể sử dụng để phân biệt X và Y là tất cả các chất: dung dịch NH3, dung dịch KMnO4 trong H2SO4, kim loại Cu
Câu 13. Có các nhận xét sau:
(1) Nhúng thanh Fe vào dung dịch FeCl3 xảy ra ăn mòn điện hóa.
(2) Sục khí H2S vào dung dịch CuSO4 thấy xuất hiện kết tủa màu xanh nhạt.
(3) Nhỏ dung dịch Na2CO3 vào dung dịch FeCl3 thấy có kết tủa màu đỏ nâu và thoát khí.
(4) Nhúng thanh nhôm vào dung dịch NaOH loãng nguội, thấy thanh nhôm tan dần.
(5) Đốt cháy dây sắt trong khí clo thấy hình thành muối sắt (II) clorua bám trên thanh sắt. Số nhận xét đúng là
A. 1
B. 2
C. 3
D. 4
Lời giải:
(1) sai vì không tạo thành cặp điện cực có bản chất khác nhau
(2) sai vì tạo kết tủa CuS có màu đen
(3) đúng, vì ban đầu tạo Fe2(CO3)3 muối này không bền nên bị thủy phân tạo Fe(OH)3 màu đỏ nâu và thoát khí CO2
3Na2CO3 + 2FeCl3 + 3H2O → 6NaCl + 2Fe(OH)3 + 3CO2
(4) đúng, vì Al tan được trong dung dịch NaOH:
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
(5) sai vì Fe tác dụng với Cl2 đun nóng tạo thành FeCl3
2Fe + 3Cl2 → 2FeCl3
Vậy có tất cả 2 nhận xét đúng
Câu 14. Có bao nhiêu chất trong các chất cho sau đây mà khi nung trong không khí đến khối lượng không đổi thu được chất rắn mới có khối lượng nhỏ hơn chất rắn ban đầu: NaHCO3, NaNO3, NH4Cl, I2, K2CO3, Fe, Fe(OH)3 và FeS2?
A. 4.
B. 6.
C. 3.
D. 5.
Lời giải:
Các chất có phản ứng tạo ra chất mới ở thể rắn và khí thì chất đó sẽ có khối lượng rắn nhỏ hơn.
Đặt số mol mỗi chất đem nung là 1 mol
Các chất khi nhiệt phân thu được rắn có khối lượng nhỏ hơn là: NaHCO3, NaNO3, Fe(OH)3, FeS2
2NaHCO3(r) ⟶ Na2CO3 (r) + CO2↑ (k) + H2O(h)
2NaNO3(r) ⟶ 2NaNO2(r) + O2(k)
2Fe(OH)3 (r)⟶ Fe2O3 (r) + 3H2O(h)
4FeS2(r) + 11O2 ⟶ 2Fe2O3(r) + 8SO2(k)
→ có 4 chất
Xem thêm các phương trình hóa học khác:
Xem thêm các chương trình khác:
- Các dạng bài tập Tiếng Anh thông dụng nhất
- 3000 câu hỏi ôn tập môn Tiếng Anh có đáp án
- Toàn bộ kiến thức về cụm động từ | Định nghĩa và cách dùng
- 500 đoạn văn Tiếng Anh thông dụng nhất và cách làm
- 1000 câu hỏi ôn tập môn Công nghệ có đáp án
- 1000 câu hỏi ôn tập Giáo dục công dân
- 15000 câu hỏi ôn tập môn Toán có đáp án
- Wiki Toán | Khái niệm, định lí, tính chất, dạng bài, công thức
- Tuyển tập đề thi + chuyên đề ôn thi Toán Kangaroo các cấp độ (có đáp án 2024)
- 3000 câu hỏi ôn tập môn Vật lí có đáp án
- Tổng hợp Dạng bài - Công thức môn Vật lí
- 2000 câu hỏi ôn tập môn Tin học có đáp án
- 3000 câu hỏi ôn tập môn Lịch sử có đáp án
- 3000 câu hỏi ôn tập môn Địa lí có đáp án
- 2000 câu hỏi ôn tập môn Sinh học có đáp án
- Tổng hợp Dạng bài - Công thức môn Sinh học
- Tổng hợp về các tác giả văn học
- 3000 câu hỏi ôn tập môn Ngữ văn có đáp án
- Tổng hợp kiến thức Ngữ Văn
- Trò chơi Powerpoint | Game Powerpoint
- Tổng hợp bài thu hoạch BDTX Giáo viên mầm non (2024) theo Thông tư 12
- Tổng hợp bài thu hoạch BDTX Giáo viên tiểu học (2024)
- Tổng hợp bài thu hoạch BDTX Giáo viên THCS (2024)
- Tổng hợp bài thu hoạch BDTX Giáo viên THPT (2024)
